Año 2, Número 1. Septiembre - Diciembre, 2014 
Depuración del efluente de un rastro municipal mediante la aplicación del proceso Fenton
Purification of effluent from a municipal place of slaughter of animals by applying the Fenton process
Universidad Tecnológica de León
Por: Javier Páramo Vargas, Juan Manuel Peralta Hernández y Eloy Isarain Chávez / Ver en pantalla completa
Resumen
Fenton, es uno de los procesos de oxidación avanzada, basado en el uso de radicales hidroxilo para la oxidación química de contaminantes, fue evaluado para la depuración del efluente de un digestor anaerobio de un rastro.
El efluente presenta valores iniciales de demanda química de oxígeno (DQO) en DQOtotal de 1159.2 mg/L y DQOdisuelta de 342.9 mg/L. El proceso oxidativo fue monitoreado mediante la DQOdisuelta determinada por el método de reflujo cerrado. Las concentraciones iniciales de sulfato ferroso (FeSO4.7H2O) y peróxido de hidrógeno (H2O2) fueron las variables estudiadas, con valores de 0.5, 1 y 2 mM en el primer caso y de 200, 300 y 500 mg/L para el último.
Se evaluó la coagulación y la oxidación química, participantes en la remoción de la DQO, proceso que resultó ser muy rápido, pues en 10 minutos se alcanza una condición final estable, con una alta eficiencia en la remoción de la DQO total, del 95%, que permite el cumplimiento normativo.
Reactivo de Fenton, procesos de oxidación avanzada, aguas residuales de rastro.
Abstract
The Fenton process, which is one of the advanced oxidation processes and is based on the use of hydroxyl radicals for the chemical oxidation of pollutants, was evaluated for the depuration of the effluent of an anaerobic digester of a slaugtherhouse.
Effluent has initial values of chemical oxygen demand (COD) of: CODtotal of 1159.2 mg/L and CODdissolved of 342.9 mg/L. The oxidative process was followed by the CODdissolved determined by the method of closed reflux. Ferrous sulphate (FeSO4.7H2O) and hydrogen peroxide (H2O2) initial concentrations were the variables studied, with values of: 0.5, 1 and 2 mM in the first case and values of 200, 300 and 500 mg/L for the last one.
The coagulation and chemical oxidation were involved in the removal of COD, which was a very fast process. It was obtained a high efficiency in the total COD removal of 95%, which allows the regulatory compliance.
Fenton's reagent, advanced oxidation processes, wastewater trace.
Introducción
El agua es un valioso recurso y según estadísticas, la fracción disponible para ser usada por el hombre (agua dulce en ríos, lagos y acuíferos) representa el 0.001% de agua estimada del planeta, equivalente entre 9000 y 14000 km3 al año [1]. Por ello es muy importante hacer un uso eficiente de este recurso reduciendo el consumo del mismo, así como el disponer de tecnologías que posibiliten su reúso que cumplan con la normatividad aplicable.
En este marco de necesidades y oportunidades de acción, surgen proyectos ambientales, como el caso del rastro municipal de la ciudad de León, Guanajuato en México. En el país hay 1141 centros de sacrificio de especies pecuarias, de los cuales 55 se ubican en el estado de Guanajuato y representa sólo el 4.8%. Cinco de estos centros de sacrificio son establecimientos de tipo inspección federal [2].
El agua residual que se genera en estos centros se caracteriza por su alto contenido de materia orgánica y sales [2, 3]. En este proyecto se evaluó la depuración del efluente del digestor anaerobio instalado en el rastro de León, mediante el proceso Fenton, proceso de oxidación avanzada basado en la oxidación química mediante radicales hidroxilo (•OH), que tienen un alto potencial de reducción (E°(•OH/H2O = 2.8 V/Standard Hydrogen electrode SHE)) [4]. Estos radicales pueden ser generados mediante el uso de distintas sales de metales de transición [5]; en esta reacción, denominada reacción de Fenton, se da la disociación del peróxido de hidrógeno (H2O2) en medio ácido, formando radicales hidroxilo, siendo el ión ferroso Fe2+, el que la inicia y cataliza (reacción 1) [6, 7].
![]()
Los radicales hidroxilo pueden reaccionar entonces con los iones ferrosos, materia orgánica (reacciones 2 y 3) [7], formar radicales menos oxidantes como el hidroxiperoxilo al reaccionar con el peróxido de hidrógeno (reacción 4) [7] e incluso generar nuevamente peróxido de hidrógeno (reacción 5) [7].
![]()
![]()
![]()
![]()
Como se mencionó anteriormente, el proceso Fenton se lleva a cabo en medio ácido [5], encontrándose en este caso en ensayos previos el pH de 3 como el más adecuado, ya que también favorece la existencia de la especie Fe2+. Bajo esta condición se lleva a cabo la formación de hidroxocomplejos férricos [Fe(H2O)4(OH)2] [8], que dan al proceso Fenton la capacidad de coagulación. El equilibrio químico es muy importante, pues para favorecer la condición de oxidación química debe existir en exceso H2O2. Hoy día este tipo de tecnologías tiene un gran desarrollo en aplicaciones con contaminantes recalcitrantes [4], pero en la década de los 80´s tuvo un gran desarrollo en aplicaciones a aguas residuales con contaminantes orgánicos [9] y últimamente ha crecido el uso combinado como pretratamiento o postratamiento [10, 11].
El presente estudio evaluó la influencia de la concentración inicial de peróxido de hidrógeno (H2O2)o y de ión ferroso [Fe2+]o en el proceso Fenton aplicado para depurar el efluente del rastro de León, considerando experiencias anteriores con aguas similares [3, 12], a fin de poder desarrollar una propuesta tecnológica.
Materiales y reactivos
El agua con que se llevaron a cabo los experimentos, se tomó en la tubería de salida del digestor anaerobio, preservando las muestras a 4°C. La demanda química de oxígeno (DQO) se estableció como la variable para evaluar el proceso de depuración y se analizó conforme a la norma (NMX-AA-030/2-SCFI-2011), midiendo la fracción disuelta (DQOd) para monitorear el proceso y la total (DQOt) al inicio para fines comparativos.
El sulfato ferroso (FeSO4.7H2O) (99.9%), el peróxido de hidrógeno (30%) y otros reactivos, fueron grado analítico y adquiridos a Karal S.A. de C.V. La medición de pH se realizó con un equipo HACH Sension 156, las determinaciones colorimétricas fueron con un espectrofotómetro UV Evolution 300 UV-VIS, marca Thermo Scientific y para la DQO se usó un reactor de DQO, modelo HI839800 marca Hanna Instruments.
La determinación de hierro se basó en la medición de la absorbancia con el espectrofotómetro de UV a una λ = 508 nm del complejo formado entre el Fe2+ y la orto-fenantrolina, calculando la concentración mediante una curva de calibración [13]. La determinación de peróxido de hidrógeno se basó en la formación de un complejo con oxisulfato de titanio, la medición espectrofotométrica de la absorción a una λ = 406 nm [14] y la determinación de concentración mediante una curva de calibración.
Experimentación
Las reacciones tipo Fenton se llevaron a cabo en un reactor de 1 L, trabajando por lotes y monitoreando periódicamente el curso del proceso (tiempos de 0, 2.5, 5, 7.5, 10, 20, 30, 40, 50 y 60 minutos). La elección de los niveles de trabajo para las variables de Fe2+ y H2O2, se hizo considerando la caracterización del efluente y la estequiometría de la reacción de descomposición del H2O2.
![]()
Así, se estudió el comportamiento de la concentración de la DQOd, con valores de Fe2+ de 0.5, 1 y 2 mM, valores de H2O2 de 200, 300 y 500 mg/L. En cada muestra tomada se midió la DQOd, Fe2+ y H2O2.
Resultados
La tabla I, muestra los resultados de la caracterización del efluente del rastro en los parámetros de: demanda bioquímica de oxígeno (DBO5), DQOt, DQOd, sólidos suspendidos totales (SST), conductividad y pH. Su análisis indica un alto contenido de materia orgánica, sólidos suspendidos y sales.
| DBO5 (mg/L) | DQOt (mg/L) | DQOd (mg/L) | SST (mg/L) | Conductividad (mS/cm) | pH |
| 205.2 | 1159.2 | 342.9 | 530 | 6.0 | 7.8 |
En la figura 1 se muestra la interacción de los efectos del [Fe2+]o y (H2O2)o en la remoción de la DQOd, mientras que en la Figura 2 se muestra el comportamiento de la DQOd en la mejor condición de tratamiento.
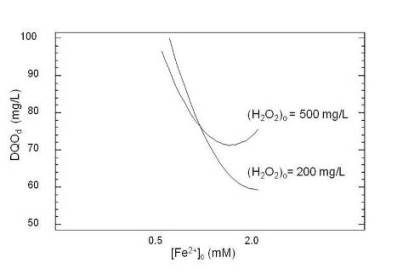
Fig. 1. Interacción de los factores [Fe2+]0 y (H2O2)0, en el tratamiento Fenton.
Condiciones experimentales: DQOo(d) de 342.9 mg/L y pH de 3.
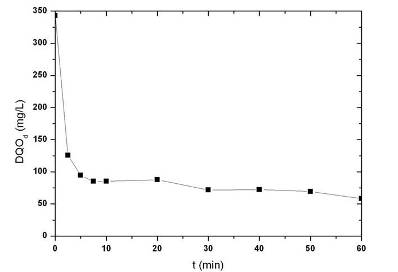
Fig. 2. Evolución del proceso oxidativo para una DQOo(d) = 342.9 mg/L, pH = 3, [Fe2+]o = 2 mM y (H2O2)o = 200 mg/L.
Al inicio se dio una rápida remoción de la DQO, por la generación de radicales •OH y iones Fe3+ (reacción 1), alcanzándose valores casi estables de DQOd en 10 minutos, consistente con la rápida reducción que se observó de iones Fe2+ y H2O2. Las diferentes especies de hierro se redujeron drásticamente, lo cual indica la importancia del efecto de coagulación por la formación de hidroxocomplejos férricos que retiraron el hierro de la solución, generando en promedio 100 ml/L de sólidos sedimentables finales. Por otra parte, la rápida disminución observada de la concentración de H2O2, hizo evidente la oxidación química, a través del proceso Fenton (reacciones 1 a 5). Al aplicar el tratamiento Fenton al efluente problema los valores de la DQOd más bajos se obtuvieron con una [Fe2+]o de 2 mM para los diferentes niveles de H2O2 y fueron: 58.4 mg/L ((H2O2)o de 200 mg/L), 82.2 mg/L ((H2O2)o de 300 mg/L) y 72.7 mg/L ((H2O2)o de 500 mg/L). Lo anterior se traduce a una mejora en la calidad del agua, que se confirma con lo mostrado en la Figura 3. Los mejores resultados se obtuvieron con el menor valor de (H2O2)o, mientras que al aumentar su concentración es mayor la reacción no útil entre los radicales •OH formados y el H2O2 residual, por ser esta reacción más rápida como lo indican sus constantes cinéticas (reacción 1, K=70 M-1s-1 y la reacción 4, K=3.3X107 M-1s-1) [15]; además de que los radicales hidroxiperoxilo generados (reacción 4), tienen menor poder oxidante que los radicales •OH.

Fig. 3. Tratamiento Fenton: efluente original (izquierda); al centro (efluente tratado con [Fe2+]o = 1 mM y (H2O2)o = 300 mg/L) y a la derecha (efluente tratado con [Fe2+]o = 2 mM y (H2O2)o = 200 mg/L).
Por otra parte, los ensayos realizados con concentraciones iniciales de Fe2+ y H2O2 fuera de los intervalos experimentales trabajados, mostraron la correcta elección de los mismos; pues a valores menores la calidad del agua tratada disminuía, mientras que en el caso contrario la calidad del agua tratada se mantenía prácticamente constante, pero con mayores concentraciones de hierro disueltas. Finalmente, el análisis de la cinética de la figura 2, sirve de base para el establecimiento de las condiciones de trabajo para la aplicación de este proceso a una escala mayor con la posibilidad de elegir 2 alternativas: a) bajos tiempos de retención, que implican menor tamaño del reactor y b) mayor tiempo de retención que implica un mayor tamaño de reactor y mejor eficiencia del tratamiento. Esto debe analizarse en conjunto con otros aspectos como la disponibilidad de terreno y el uso que se quiera dar al agua tratada.
Conclusiones
En este estudio, la mejor condición obtenida, fue una DQOd residual de 58.4 mg/L, con las concentraciones iniciales de 2 mM de Fe2+ y 200 mg/L de H2O2; correspondiente a un porcentaje de remoción del 95%, lo cual garantiza el cumplimiento normativo del efluente tratado en los parámetros de interés referidos de DQO y DBO5. Para la aplicación, en función del uso a que se pretenda destinar el agua tratada, se puede usar una menor concentración de hierro como la de 1 mM, lo que permite además del cumplimiento normativo, ahorro en el costo de reactivos. Esto se comprobó al hacer una caracterización del efluente tratado bajo la condición de [Fe2+]o de 1 mM y (H2O2)o de 200 mg/L, obteniendo los siguientes valores: DBO5< 7 mg/L, DQOd de 79.3 mg/L, DQOt de 95.4 mg/L, SST de 77 mg/L, valores inferiores a lo establecido en la NOM-001-SEMARNAT-2001. Los resultados mostraron un nivel de tratamiento adecuado lo cual abre la posibilidad de considerar el reúso del agua mediante el complemento con algunas otras tecnologías que así lo permitan.
Referencias
1. PUIG, G.P., El agua virtual: conceptos e implicaciones, in Redalyc.org. 2012. p. 69-76.
2. COFEPRIS, Evaluación de riesgos de los rastros y mataderos municipales. 2006, COFEPRIS: México. p. 67.
3. VALERIA CASTILLO ROBLEDO, M.A.V.R. Propuestas de reingeniería del proceso aerobio y diseño de un tratamiento terciario en el rastro frigorífico de León, in Ingeniería Ambiental. 2012, Universidad Tecnológica de León: León. p. 94.
4. ISARAIN-CHÁVEZ, E. et al., Mineralization of the drug β-blocker atenolol by electro-Fenton and photoelectro-Fenton using an air-diffusion cathode for H2O2 electrogeneration combined with a carbon-felt cathode for Fe2+ regeneration. Applied Catalysis B: Environmental, 2010. 96(3–4): p. 361-369.
5. NEYENS, E. and BAEYENS, J., A review of classic Fenton’s peroxidation as an advanced oxidation technique. Journal of Hazardous Materials, 2003. 98(1–3): p. 33-50.
6. PERALTA-HERNÁNDEZ, J.M. et al., Comparison of hydrogen peroxide-based processes for treating dye-containing wastewater: Decolorization and destruction of Orange II azo dye in dilute solution. Dyes and Pigments, 2008. 76(3): p. 656-662.
7. PERALTA-HERNÁNDEZ, J.M. et al., In situ electrochemical and photo-electrochemical generation of the fenton reagent: A potentially important new water treatment technology. Water Research, 2006. 40(9): p. 1754-1762.
8. LIN, S.H. and Lo, C.C., Fenton process for treatment of desizing wastewater. Water Research, 1997. 31(8): p. 2050-2056.
9. SANDIP, S.; RUPARELIA, J.P. and PATEL M. L., A general review on advanced oxidation processes for waste water treatment. Institute of Technology, Nirma University, Ahmedabad, 2011. p. 382-481.
10. OLLER, I.; MALATO, S. and SÁNCHEZ-PÉREZ J.A., Combination of Advanced Oxidation Processes and biological treatments for wastewater decontamination—A review. Science of The Total Environment, 2011. 409(20): p. 4141-4166.
11. GARCÍA GÁMEZ, C.; GORTÁREZ MOROYOQUI, P. and DROGUI P. Tratamientos biológicos y de oxidación avanzada combinados para una solución a la biotecnología ambiental, 2011. 6, p. 585-605.
12. DE SENA, R.F. et al., Treatment of meat industry wastewater using dissolved air flotation and advanced oxidation processes monitored by GC–MS and LC–MS. Chemical Engineering Journal, 2009. 152(1): p. 151-157.
13. AMERICAN PUBLIC HEALTH ASSOCIATION, A.W.W.A., Water Environment Federation ed. Standard Methods for the examination of water and wastewater. 20th ed. Vol. 1. American Public Health Association: Washington, USA., 1998.
14. HERMOSILLA, D.; CORTIJO, M. and HUANG, C.P. The role of iron on the degradation and mineralization of organic compounds using conventional Fenton and photo-Fenton processes. Chemical Engineering Journal, 2009. 155(3): p. 637-646.
15. WU, Y. et al., Modeling the oxidation kinetics of Fenton´s process on the degradation of humic acid. Journal of Hazardous Materials, 2010. 179: p. 533-539.



