Año 7, Número 3. Mayo - Agosto, 2020. 
Elaboración artesanal de coagulante con exoesqueletos de camarón para el tratamiento de agua residual
Artisanal production of coagulant with shrimp exoskeletons for wastewater treatment
Universidad Autónoma Chapingo
Por: Álvaro Vélez Torres, Antonio Vázquez Alarcón / Ver en pantalla completa
Resumen
El chitosán es un polisacárido orgánico que ha sido usado en el tratamiento de aguas residuales. Sin embargo, su obtención involucra una gran cantidad de subfases, reactivos y aparatos de laboratorio, lo cual restringe su producción de forma artesanal. En este sentido, se elaboró un coagulante orgánico a base de exoesqueletos de camarón y ácido clorhídrico, que permitió remover materia orgánica de agua residual proveniente de la planta de tratamientos de la Universidad Autónoma Chapingo. Algunos resultados destacados muestran que con una proporción de 3 gramos de exoesqueletos de camarón en 100 mililitros de ácido clorhídrico al 37 por ciento y con un tiempo de contacto de 15 a 20 minutos se puede elaborar una solución que promueve la coagulación de agua residual. Además, que dicha solución puede ser almacenada hasta por dos semanas en refrigeración a 4 °C para retardar la desacetilación.
Palabras clave: desacetilación, chitosán, coagulante orgánico.
Abstract
Chitosan is an organic polysaccharide that has been used in wastewater treatment. However, its acquisition involves a large number of sub-phases, reagents and laboratory devices, which restricts its production by hand. In this sense, an organic coagulant based on shrimp exoskeletons and hydrochloric acid was developed that allowed the removal of organic matter from wastewater from the treatment plant of the Chapingo Autonomous University. Some outstanding results show that with a proportion of 3 to 5 grams of shrimp exoskeletons in 100 milliliters of 37 percent hydrochloric acid and with a contact time of 15 to 20 minutes, a solution that promotes the coagulation of residual water can be developed. In addition, that said solution can be stored for up to two weeks in refrigeration at 4 ° C to delay deacetylation.
Keywords: Turbidity, chitosan, organic coagulant.
Introducción
En el contexto de la crisis mundial del agua y sus consecuencias sociales, ambientales y económicas, se ha incrementado la preocupación de la comunidad científica y de los tomadores de decisiones para el desarrollo de investigación aplicada al saneamiento del agua residual (WWAP, 2016)¹. Entre ellas podemos mencionar el desarrollo de polímeros biodegradables.
En este sentido, los coagulantes orgánicos han sido ampliamente usados en la industria del tratamiento de agua residual debido a su alta eficiencia con dosis bajas en comparación con los coagulantes inorgánicos (Nechita, 2017)². Sin embargo, en la mayoría de los tratamientos convencionales para agua residual, las sales de metales multivalentes son usadas para el proceso de coagulación por su bajo costo y fácil uso, pero presentan el inconveniente de aumentar la concentración de metales en las aguas tratadas (Nechita, 2017) ².
En este contexto, el polímero orgánico chitosán tiene una importante aplicación debido a su gran capacidad de absorber y remover los contaminantes de las aguas residuales. Además, el chitosán es biodegradable, no tóxico y abundante en la naturaleza** (Ahmad et al, 2015)³.
Otra característica del chitosán es que puede ser usado como un agente coagulante y floculante en aguas residuales debido a su alta capacidad de absorción*** (Zha, Li y Chang, 2008)⁴. En este sentido, la coagulación y la floculación**** usando chitosán se explica por la remoción de cargas negativas de materiales coloidales orgánicos o impurezas inorgánicas de las aguas residuales (Szygula et al., 2009)⁷. Además, su acción coagulante es muy eficiente comparada con los coagulantes minerales tales como el sulfato de aluminio (Nechita, 2017)². De esta manera, el chitosán puede ser un potencial sustituto de las sales de aluminio y los polímeros sintéticos en el tratamiento del agua residual debido a que evita los efectos residuales del aluminio trivalente en la salud y produce lodos biodegradables (Ruhsing Pan et al., 1999)⁸.
Para obtener el chitosán, la forma convencional es a través de tres procesos: desproteinización, desacetilación y decoloración. Sin embargo, dichos procesos involucran una gran cantidad de reactivos y aparatos de laboratorio que dificultan su obtención de manera directa, artesanal y económica. Desprendido de esta problemática se plantea la siguiente interrogante ¿Es posible, mediante un proceso de desacetilación a exoesqueletos de camarón, obtener un coagulante orgánico útil en el tratamiento de agua residual? En consecuencia, el objetivo de este trabajo de investigación fue elaborar un coagulante orgánico a base de exoesqueletos de camarón usando ácido clorhídrico al 37 por ciento como agente desacetilador.
Para este trabajo se usaron exoesqueletos de camarón procedentes de un restaurante de mariscos, el agua residual fue colectada de la planta de tratamiento de la Universidad Autónoma Chapingo. Además, las pruebas fueron realizadas en un laboratorio del Departamento de Suelos de la misma universidad.
El enfoque metodológico empleado en este trabajo se dividió en dos etapas. En la primera se estableció un procedimiento para la obtención del coagulante orgánico que tomó en cuenta la cantidad de exoesqueletos de camarón, la concentración de ácido clorhídrico y el tiempo de contacto. En la segunda parte, se comparó el desempeño del coagulante orgánico sintetizado en este trabajo de investigación en relación con un coagulante inorgánico a base de sulfato de aluminio. En este sentido, las pruebas fueron para determinar las curvas de sedimentación en conos Imhoff, para determinar sólidos totales, para cuantificar turbidez y medir pH.
En ambas etapas se usó un diseño experimental de bloques al azar con tres repeticiones. Los resultados de las pruebas realizadas indican que se puede producir un coagulante orgánico al poner en contacto 3 gramos de exoesqueletos de camarón con 100 mililitros de ácido clorhídrico al 37 por ciento de pureza con un tiempo de contacto de 15 a 20 minutos. Dicho coagulante promovió la coagulación y la floculación en agua residual. En este sentido, se detectó que el color de la solución nos indica el grado de desacetilización, por ejemplo: con un tiempo de contacto de 15 a 20 minutos, la solución adquiere un color café, en cuyo caso promueve la coagulación del agua residual. Sin embargo, si la solución permanece a temperatura ambiente por más tiempo de 20 minutos, adquiere un color púrpura y deja de propiciar la coagulación en agua residual. En este sentido, el coagulante orgánico puede ser almacenado en refrigeración a 4°C por un periodo de hasta dos semanas y continuar propiciando la coagulación y floculación en agua residual.
* Sustancias moleculares de peso molecular elevado, formados por la polimerización –unión- de monómeros de peso molecular bajo (Brown et al, 1993)⁵.
** El chitosán es un polímero natural presente en los exoesqueletos de crustáceos; abundante y disponible en la naturaleza, y de fácil producción en incontables partes del mundo. Además, el chitosán es un material que puede mejorar las condiciones de vida en países en desarrollo en donde la industria a menudo sobrepasa la necesidad de proteger el ambiente, o donde los recursos económicos son limitantes para proteger el ambiente (Ahmad et al, 2015)³.
*** La absorción en el tratamiento de aguas residuales ha llamado la atención de los científicos principalmente porque la absorción tiene una eficiencia alta, bajo costo y fácil manejo (Ahmad et al, 2015)³.
**** De esta manera, la correcta aplicación de dichos procesos y la selección del coagulante dependen de entender la interacción entre estos dos factores (Prakash et al, 2014)⁶.
Materiales y métodos
El trabajo fue dividido en dos etapas. La primera fue para obtener un procedimiento que relacionó la cantidad de exoesqueletos de camarón, la cantidad de ácido clorhídrico y el tiempo de contacto. La segunda etapa consistió en hacer pruebas de coagulación y floculación con el coagulante orgánico obtenido en agua residual. Paralelamente, se hicieron pruebas con el coagulante inorgánico sulfato de aluminio, para comparar el desempeño del coagulante orgánico producido.
Etapa uno
En esta fase se usó un método de bloques completamente al azar con tres repeticiones, como sugieren (Bustamante y Valbuena, 2015)⁹ en procesos orgánicos. En este estudio, el primer paso fue obtener una fórmula que relacionara la cantidad de exoesqueletos de camarón, el volumen de ácido clorhídrico y el tiempo de contacto. Para esto, se evaluaron diferentes cantidades de exoesqueletos de camarón, diferentes volúmenes de ácido clorhídrico, así como tiempos de contacto*. Para estandarizar la fórmula se procedió de la siguiente manera:
- Se hicieron pruebas en tubos de ensayo, se mezclaron variables cantidades de exoesqueletos de camarón con diferentes volúmenes de ácido clorhídrico, y se contó el tiempo de contacto. Con respecto a la cantidad de exoesqueletos de camarón el peso osciló entre 1 y 5 gramos, y el volumen de ácido clorhídrico entre 10 y 100 mililitros. En relación al tiempo de contacto, fue de 15 a 20 minutos.
- Con las muestras obtenidas en cada ensayo, se probó la eficiencia de la solución, aplicándola directamente en muestras de aguas grises- del trapeado de pisos-.
- El proceso -inductivo- se repitió hasta que la fórmula fue consistente.
En esta misma etapa, se ensayó la influencia de la temperatura en el proceso de desacetilación. En este sentido se almacenó la solución de chitosán a temperatura de 4 °C. Posteriormente, se probó la solución cada 24 horas para verificar si propiciaba la coagulación en agua residual cruda.
Etapa dos
Una vez obtenido el procedimiento para la elaboración del coagulante orgánico, se efectuaron las pruebas del desempeño en agua residual, esta vez no se usaron aguas grises. Primero se corroboró que el procedimiento fuera consistente en pruebas con mayor volumen de agua y concentración de sólidos disueltos.
Los pasos fueron:
- Colectar aguas residuales sin tratamiento.
- Producir el coagulante orgánico con 50 gramos de exoesqueletos de camarón en 1 litro de ácido clorhídrico al 37 %.
- Producir la solución coagulante con sulfato de aluminio con 5 gramos de sulfato de aluminio en 1 litro de agua residual (5000mg Lˉ¹).
- Determinar las curvas de sedimentación con conos Imhoff.
- Determinar sólidos totales.
- Cuantificar la turbidez.
- Medir pH.
* La consideración de que el tiempo de contacto era una variable importante en el proceso de obtención del coagulante se derivó de evidencias empíricas donde se observó que si los exoesqueletos de camarón permanecían en contacto del ácido clorhídrico por más de una hora la solución obtenida no propiciaba la coagulación de aguas grises (Vélez y Lara, 2017)¹⁰.
Resultados y discusión
Fase 1: relación entre exoesqueletos de camarón y volumen de ácido clorhídrico
Se monitoreó la cantidad de exoesqueletos de camarón de 0.5 a 5 gramos en 10 mililitros de ácido clorhídrico con tiempo de contacto de 15 a 20 minutos. En este sentido, cuando se usa una concentración de 3 gramos de exoesqueletos de camarón por 10 mililitros de ácido clorhídrico al 37 por ciento, la solución obtenida promueve la coagulación en agua residual (ver Figura 2). Por el contrario, cuando se usan más de 3 gramos de exoesqueletos de camarón en el mismo volumen de ácido clorhídrico, la solución no mejora el desempeño de la coagulación en agua residual e incluso no la propicia. Por ejemplo, en la Figura 1 podemos observar de izquierda a derecha que de la solución numero 1 a la número 3 no se aprecia la coagulación del agua residual. Cabe mencionar que la cantidad de exoesqueletos usada fue de 4, 5 y 6 gramos respectivamente. Por el contrario, en la solución 4 y 5 se observa en la parte superior de los tubos de ensayo la materia orgánica removida del agua residual. En este caso se usaron 3 y 2.5 gramos de exoesqueletos de camarón respectivamente.

Figura 1. Cantidad de exoesqueletos de camarón Fuente: Elaboración propia.
Indicador de acetilación débil
Los resultados de Il´ina et al (2004)¹¹ sugieren que para que se produzca la desacetilación del chitin con ácido clorhídrico, la pureza del ácido debe ser del 30 por ciento y el tiempo de contacto de una hora, sin embargo no especifica la cantidad de chitin, ni el tipo. En este proyecto de investigación se usó ácido clorhídrico al 37 por ciento de pureza y exoesqueletos de camarón, la diferencia en la pureza del ácido propuesta por Il´ina et al (2004)¹¹ y la pureza del ácido usado en este proyecto es mínima. Sin embargo, la diferencia de concentración del ácido, así como el tiempo de contacto influyen directamente en la desacetilación. Para determinar de qué manera influyen dichos factores, es necesario considerar que si el tiempo de contacto entre el ácido clorhídrico y el chitin es mayor al necesario, se producirá chitano, el cual no tiene las mismas propiedades que el chitosán para promover la coagulación (Figura 2).
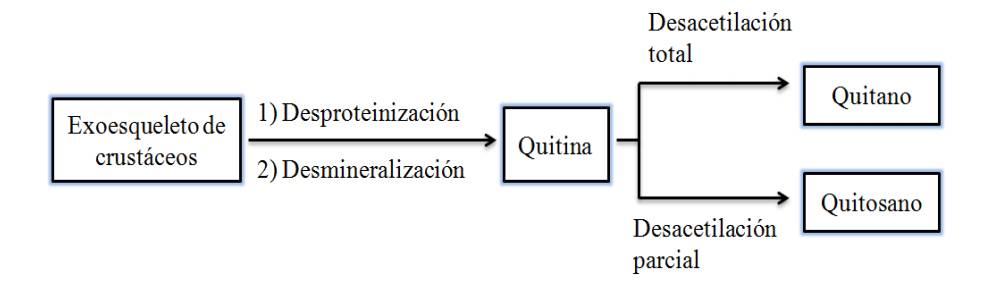
Figura 2. Obtención de chitosán y chitosano Fuente: Colinas et al. (2014)¹²
Lo que señalan Colinas et al. (2014)¹² es que el chitosán se produce en presencia de una desacetilación parcial, lo cual se puede conseguir disminuyendo la concentración del ácido clorhídrico, o bien, disminuyendo el tiempo de contacto. De esta manera, se necesita un indicador que nos permita monitorear dichos procesos. En esta investigación se observó que cuando se usa ácido clorhídrico al 37 por ciento de pureza en 50 gramos de exoesqueletos de camarón con un tiempo de contacto entre 15 y 20 minutos la solución adquiere un color café oscuro. Sin embargo, si el tiempo de contacto sobrepasa este rango, la solución comienza a tornarse color púrpura. El cambio de color es relevante debido a que la solución de color café promueve la coagulación en agua residual. Por el contrario, la solución de color púrpura no promueve la coagulación en agua residual. De esta manera, el color café nos indica una desacetilación débil, en cuyo caso se produce una solución con chitosán; por el contrario, el color púrpura nos indica una desacetilación total, que propiciará chitano.
Respecto a la desacetilación, (García 2008)¹³ reconoce que la temperatura desempeña un papel importante, así como la concentración y el tiempo de contacto. Sin embargo, no encontramos referencias bibliográficas de elaboración de chitosán de forma artesanal que refiera la relación entre color y temperatura con el grado de desacetilación. En nuestro caso de estudio, la solución en refrigeración puede ser almacenada hasta por dos semanas, y continuar promoviendo la coagulación de la materia orgánica en agua residual. Pasado dicho tiempo, la solución adquiere una tonalidad púrpura y deja de propiciar la coagulación en agua residual.
Fase 2: desempeño del coagulante
En esta fase, se monitoreó la remoción de materia orgánica, la turbidez y el pH. Con base en estos parámetros se comparó el desempeño del coagulante obtenido contra el desempeño del sulfato de aluminio en la coagulación y floculación de agua residual. La solución de sulfato de aluminio usada fue de 5 gramos de sulfato de aluminio en 1 litro de agua destilad, se usó esa concentración (5000mg Lˉ¹) debido a que es la empleada comúnmente en procesos de tratamiento químico del agua residual. Con respecto al agua usada para esta fase, se obtuvo en el cárcamo de entrada de la planta de tratamiento de agua residual de la Universidad Autónoma Chapingo.
Curva de sedimentación
Para determinar la curva de sedimentación se usaron conos Imhoff. Además, se usó agua cruda proveniente de la planta de tratamientos de agua residual de la Universidad Autónoma Chapingo. En el presente estudio se usaron 100 mililitros del coagulante sintetizado y 100 mililitros de coagulante inorgánico por litro de agua residual. En relación al volumen de coagulante sintetizado se obtuvo de ensayo directo, y se encontró que este volumen propiciaba el mejor resultado de coagulación en agua residual.
Tabla 1. Curvas de sedimentación
| Tiempo de sedimentación (minutos) | Sedimentos de sulfato de aluminio (mililitros) | Sedimentos de coagulante orgánico (mililitros) |
| 1 | 1 | 1 |
| 2 | 2 | 1 |
| 10 | 100 | 150 |
| 15 | 80 | 100 |
| 20 | 70 | 90 |
| 30 | 60 | 80 |
| 50 | 30 | 50 |
Al principio de los ensayos, la coagulación de la materia orgánica en ambos casos ocurrió en el primer minuto, posteriormente la tasa de sedimentación comenzó a disminuir, hasta que se estabilizó al minuto 50 (ver la Tabla 1). En ambos casos, la mayor tasa de sedimentación ocurrió en el minuto 10 (Figura 3).
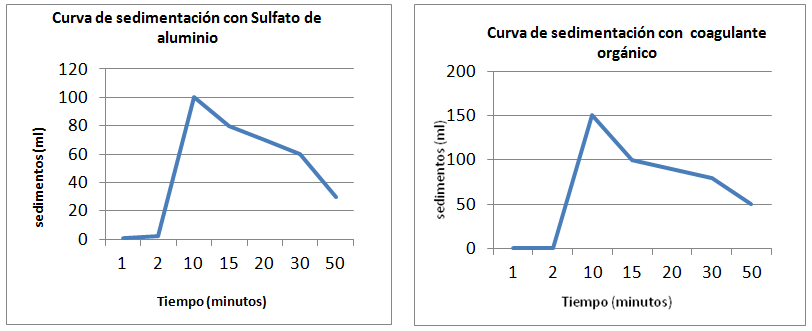
Figura 3. Tasa de sedimentación Fuente: Elaboración propia
Posteriormente, debido al peso de los flóculos, se fueron sedimentando hasta que se pudo determinar el volumen total de sedimentos, para el caso del sulfato de aluminio fueron de 30 mililitros, mientras que para el coagulante orgánico fueron de 50 mililitros. Una diferencia importante es que los flóculos que se producen con el coagulante orgánico son más grandes que los que se producen con el coagulante sintético (Figura 4).
Turbidez
El desempeño del coagulante inorgánico para clarificar el agua residual fue muy superior al desempeño del coagulante orgánico. Al inicio, la turbidez del agua residual sin tratamiento fue de 231 UNF (Unidades Nefelométricas). En el caso del agua tratada que fue expuesta al sulfato de aluminio la turbidez final fue de14 UNF. Por el contrario, para el caso del agua residual expuesta al coagulante orgánico fue de 424 UNF. Dicho valor se debe a que el color de la solución del chitosán que preparamos contribuyó a incrementar la turbidez de la muestra (Figura 4).

Figura 4. Sedimentación en conos Imhoff. A la izquierda, sulfato de aluminio; y a la derecha, coagulante orgánico. Fuente: Elaboración propia.
En este sentido, llama la atención que el coagulante obtenido en este experimento no clarificó el agua residual. Por ejemplo, en el trabajo de (Alava 2015)¹⁴ se reporta una remoción de turbidez en agua contaminada con hidrocarburos de petróleo del 98.19 por ciento. Sin embargo, en dicho trabajo se usó chitosán deshidratado (previamente obtenido en laboratorio) en solución de ácido clorhídrico al 0.1 M. Por el contrario, en este experimento el objetivo fue obtener chitosán de forma artesanal y de manera directa. En este caso, consistió en poner en contacto exoesqueletos de camarón con ácido clorhídrico al 37 por ciento para producir chitosán. De esta manera, este proceso pese a propiciar la coagulación de agua residual, no la clarifica. Dicho fenómeno puede ser explicado por el color de la solución de chitosán empleada en el proceso, que se transfiere al agua tratada.
Sólidos totales
En el agua residual cruda, sin ningún tratamiento, se estimó la cantidad de sólidos totales en 10,800 miligramos por litro o 10.8 gramos por litro. Por otro lado, los sólidos totales en el agua tratada con el coagulante sintético fueron determinados en 0.03 gramos por litro. Por el contrario, los sólidos totales en el agua residual tratada con el coagulante orgánico fueron estimados en 10.8 gramos (ver Tabla 2). Sin embargo, se propició la coagulación de la materia orgánica en el agua residual.

Tabla 2. Determinación de sólidos totales Fuente: Elaboración propia.
| Muestra | Sólidos totales gramos / litro |
| Agua residual | 10.8 |
| Agua con coagulante sintético | 0.03 |
| Agua con coagulante orgánico | 10.8 |
Paradójicamente, el coagulante orgánico que se produjo para este experimento incorpora materia orgánica en la solución. De esta manera, no fue posible determinar la cantidad de materia orgánica que remueve. Sin embargo, dicho resultado indica que el peso molecular del coagulante orgánico preparado en este experimento debe ser estimado para poder determinar su eficiencia en la remoción de materia orgánica.
Determinación de pH
El agua residual cruda tuvo un pH de 6.8, posteriormente cuando se agregó el coagulante sintético el pH varió a 6.2. Sin embargo, cuando se agregó el coagulante orgánico el pH la acidificó hasta 3.3. Corroborando los planteamientos de (Nechita 2017)² de que en soluciones ácidas el chitosán promueve la coagulación de materia orgánica. En este sentido, se puede aplicar una solución de cal para llevar el pH a un nivel neutro.
Conclusiones
Se puede obtener un coagulante orgánico a partir de exoesqueletos de camarón y ácido clorhídrico al 37 % de pureza, con un tiempo de contacto de entre 15 y 20 minutos. La fórmula que demostró mejor desempeño para propiciar la coagulación y floculación en agua residual fue la de 3 gramos de exoesqueletos de camarón en 100 mililitros de ácido clorhídrico, con un tiempo de contacto de 15 a 20 minutos.
Un aspecto relevante, es que el coagulante orgánico obtenido posee las características del chitosán que se obtiene por el método convencional: desproteinización, desmineralización y decoloración. Además, que puede ser obtenido con un método simple de forma artesanal. Por el contrario, no se puede precisar qué cantidad de chitosán está presente en el coagulante obtenido.
El indicador del grado de desacetilación en este trabajo fue el color de la solución: desacetilación débil – café oscuro, desacetilación total - color púrpura. Dicho indicador permitió determinar el tiempo de contacto entre 15 y 20 minutos para una fórmula de 3 gramos de exoesqueletos de camarón por 10 mililitros de ácido clorhídrico. Además, se puede retrasar la desacetilación refrigerando la solución a 4° C por un periodo de 15 días, pasado dicho tiempo la solución pierde su capacidad de propiciar la coagulación en agua residual.
Por otro lado, el desempeño del coagulante orgánico obtenido en este trabajo de investigación tuvo menor desempeño para remover materia orgánica y para clarificar agua residual cruda. Sin embargo, pruebas iniciales en tubos de ensayo mostraron que en 5 mililitros de agua de trapeado de pisos se podía propiciar la coagulación de materia orgánica agregando 1 mililitro del coagulante sintetizado en este documento.
Recomendaciones
Explorar el desempeño del coagulante obtenido en este trabajo de investigación en la reducción de la demanda biológica de oxígeno. Además, explorar si tiene alguna influencia en la reducción de unidades formadoras de coloides. Adicionalmente, estudiar su desempeño en otros tipos de agua residual, especialmente aguas grises (por ejemplo, agua residual de autolavados). También, explorar su desempeño en otros usos industriales, por ejemplo como película protectora para conservar vegetales. Así, como su uso combinado con algunos otros coagulantes orgánicos o sintéticos.
Recomendaciones
- Capacitar a más operadores en ajuste de rectificadora, más para no depender solo de dos operadores y darle mayor flexibilidad al proceso.
- Dar seguimiento a la aproximación de las mordazas en fresa CNC y después montarlas a la máquina rectificadora.
Referencias
1. WWAP. 2016. Programa Mundial de Evaluación de los Recursos Hídricos de las Naciones Unidas. Informe de las Naciones Unidas Sobre El desarrollo de los Recursos Hídricos en el Mundo 2016: Agua y Empleo. París, UNESCO. Disponible en http://www.unesco.org/new/es/natural-sciences/environment/water/wwap/wwdr/2016-water-and-jobs/
2. NECHITA, Petronela. Applications of Chitosan in Wastewater Treatment, Biological Activities and Application of Marine Polysaccharides, Dr. Emad Shalaby (Ed.), InTech. 2017. DOI: 10.5772/65289. Available from: https://www.intechopen.com/books/biological-activities-and-application-of-marine-polysaccharides/applications-of-chitosan-in-wastewater-treatment
3. AHMAD, Mudasir; Ahmed, Shakeel; Swami, Babu Lai and Ikram, Saiqa. Adsorption of heavy Ions: Role of Chitosan and Cellulose for Water Treatment. Int J Pharmacognosy 2015. 2 (6): 280-89. 2015. ISSN (Print): 2394-5583.
4. ZHA, F., Li, S., y Chang, Y. Preparation and absortion property of chitosan beads bearing B cyclodextrin cross-liked by 1,6 hexamethylene disocyanate. Carbohydr. Polym 2008, 72 (3): 369-570. 2008. DOI:10.1016/jcarbpol.2007.09.013
5. BROWN, Theodore; LEMAY, E..; BURSTEN, B.; WOODWARD, P. La Química, la ciencia central. México Ed. PEARSON Prentice Hall. 2014. Traducción GARCÍA HERNÁNDEZ, A. ISBN:978-607-32-2237-2.
6. PRAKASH NAHAN, B.; Vimala Sockan,; Jayakaran, P. Waste Water Treatment by Coagulation and Flocculation. International Journal of Enginnering Science and Innovative Technology. Volume 3, Issue 2. 2014. ISSN:2319-5967.
7. SZYGULA, A.; Guibal, E.; Ariño Palacín, María; Ruiz, M.; y Sastre, A. 2009. Removal of an anionic dye (Acid Blue 92) by coagulation-flocculation using chitosan. Journal of Environmental Management. Volume 90, Issue 10. Pages 2979-2886. DOI:10.1016(j.jenvman.2009.04.002.
8. RUHSING PAN, Jill; Chihpin, Hang, Shuchuan Chen, Ying-Chien Chung. Evaluation of a modified chitosan biopolymer for coagulation of colloidal particles. Physicochemical and Engineering Aspects. Volumen 147, Issue 3, 15 February 1999. Pages 359-364. DOI: 10.1016/S0927-7757(98)00588-3.
9. BUSTAMANTE, Mauricio, Valbuena, Sandra. Modelo experimental con bloques aleatorios simples y análisis multivariado para el mejoramiento de procesos orgánicos en la agroindustria. Revista LAN, Rev. esc. adm. neg. No. 78. Disponible en http://www.scielo.org.co/pdf/ean/n78/n78a03.pdf
10. VELEZ-TORRES, A. y Lara-Lara A. La construcción del conocimiento realizando prácticas reales. Textual. Año 38, Núm. 69. 103-118. 2017. Versión On-line ISSN 2395-9177versión impresa ISSN 0185-9439
11. IL´INA, A.V., Zueva, O.Y., Lopatin, S.A. and Varlamov, V.P. Enzymatic Hidrolysis of chitin. Biochemical and Microbiology, Vol. 40. No. 1, pag 35-38. 2004. DOI: 10.1023(B:ABIM.0000010348.46961.e2
12. COLINAS, M., Ayala, A., Rincón, D., Molina, J., Medina, J., Ynciarte, R., Montilla, B. Evaluación de los procesos para la obtención química de quitina y quitosano a partir de desechos de cangrejos. Escala piloto e industrial. Revista Iberoamericana de Polímeros. Volumen 15 (1), págs. 21-43. 2013. ISSN-e 0121-6651
13. GARCÍA, M. Películas y cubiertas de quitosana en la conservación de vegetales. Ciencia y Tecnología de Alimentos, Vol. 18, No. 1. Instituto de Farmacia y Alimentos, Universidad de la Habana. 2008. ISSN 0864-4497
14. ALAVA, J. Aplicaciones de quitosano como biocoagulante en aguas residuales contaminadas con hidrocarburos. Enfoque UTE, Vol. 6, número 3, Sep. 2015, pp. 52-64. ISSN 1390-6542
15. ARGANDOÑA ZAMBRANO, L., MACÍAS GARCÍA, R. Determinación de sólidos totales, suspendidos, sedimentados y volátiles, en el efluente de las lagunas de oxidación situadas en la Parroquia Colón, Cantón, Portoviejo, Provincia de Manabí, durante el período de marzo a septiembre 2013. Tesis de Licenciatura. Portoviejo-Manabí Ecuador. 2013. Páginas 211. Disponible en: http://repositorio.utm.edu.ec/bitstream/123456789/137/1/DETERMINACION%20DE%20SOLIDOS%20TOTALES%
2C%20SUSPENDIDOS%2C%20SEDIMENTADOS%20Y%20VOLATILES.pdf



