Año 11, Número 2. Enero - Abril, 2024 
Monitoreo y caracterización estequiométrica de un FotoAirLift como postratamiento a un sistema de tratamiento biológico de aire.
Monitoring and stoichiometric characterization of a AirLift Photoreactor as post-treatment to a biological air treatment system.
Centro de Innovación Aplicada en Tecnologías Competitivas (CIATEC)
Por: Luis Alfonso Torres Torres y José Octavio Saucedo Lucero / Ver en pantalla completa
Resumen
Se evaluó el desempeño de un reactor FotoAirLift (FAL) inoculado con un consorcio de microalgas/bacterias, acoplado como postratamiento a un biofiltro de lecho escurrido (BTF), que trata vapores de acetato de etilo (EA), durante 36 días de operación respecto a tasas de captura de dióxido de carbono (CO2) y producción de oxígeno (O2), además de la caracterización estequiométrica en las diferentes etapas operacionales. El FAL operó con un tiempo de residencia del gas (TR) de 57 s y cargas iniciales de CO2 producido en BTF (IL) de 1.61 ± 0.60, 2.32 ± 0.78 y 2.87 ± 1.11 g m-3 h-1. La máxima capacidad de captura (FC) se registró a una IL de 1.53 g m-3 h-1 en la etapa I con 7.36 g m-3 h-1 y una producción de O2 (p O2) de 496.86 g m-3 h-1.
Palabras clave: CO2; FotoAirLift; postratamiento; biomasa; estequiometría.
Abstract
The performance of a FotoAirLift (FAL) reactor inoculated with a microalgae/bacteria consortium, coupled as a post-treatment to a drained bed biofilter (BTF) that treats ethyl acetate (EA) vapors, was evaluated during 36 days of operation with respect to carbon dioxide (CO2) capture rates and oxygen (O2) production, in addition to the stoichiometric characterization in the different operational stages. The FAL operated with a gas residence time (TR) of 57 s and initial loads of CO2 produced in BTF (IL) of 1.61 ± 0.60, 2.32 ± 0.78 and 2.87 ± 1.11 g m-3 h-1. The maximum capture capacity (FC) was recorded at an IL of 1.53 g m-3 h-1 in stage I with 7.36 g m-3 h-1 and an O2 production (p O2) of 496.86 g m-3 h-1.
Keywords: CO2; PhotoAirLift; aftertreatment; biomass; stoichiometry.
Introducción
En la atmósfera se encuentran con frecuencia una gran cantidad de compuestos, los cuales, una vez que llegan a su destino final de transporte, causan problemas en diversos ecosistemas, así como en la salud general de la población. Estos compuestos son principalmente emitidos por actividades humanas, a través de emisiones industriales en procesos productivos, emisiones de gases de combustión por vehículos y transporte público, generación de electricidad, así como actividades de ganadería, entre otros.
Entre estos compuestos destacan los orgánicos volátiles (COV) y los gases de efecto invernadero (GEI) como el dióxido de carbono (CO2), siendo estos los principales responsables del aumento en la temperatura global o, en el caso de los COV, de la formación de esmog fotoquímico, una neblina oscura que se observa en áreas urbanizadas. Estos contaminantes atmosféricos pueden ser tratados mediante procesos biológicos, que son más económicos en términos de energía comparados con procesos fisicoquímicos, como la incineración.
Estos tratamientos implican la captura de CO2, en sistemas específicamente diseñados, para tratar fases gaseosas como los FotoAirLift (FAL), un reactor que consiste en una columna dividida verticalmente en zonas de subida y bajada que son alimentadas con burbujas de aire contaminado, lo que permite la mezcla del medio líquido y la exposición a la luz1 (ver la Figura 1), utilizando cultivos de microalgas puros o mixtos, organismos fotosintéticos con una capacidad destacada para capturar el carbono en forma de CO2 y utilizarlo como fuente de carbono para generar compuestos orgánicos, como carbohidratos, proteínas lípidos, pigmentos entre otros, que conforman biomasa microalgal y oxígeno, en un proceso conocido como fijación de carbono2 con aplicación industrial en producción de biocombustibles, fertilizantes, productos farmacéuticos, alimentos o cosméticos.
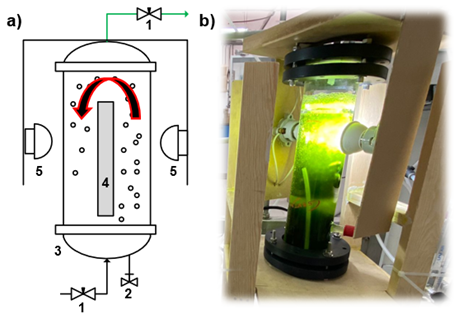
Figura 1. a) Arreglo experimental de FAL: 1) Válvula; 2) Puerto de muestreo de líquidos, 3) Columna; 4) Divisor (esponja de poliuretano); 5) Fuente de luz artificial. Fuente: elaboración propia. b) Imagen real de un FAL a escala laboratorio. Fuente: imagen propia.
El presente trabajo aborda un panorama general sobre reactores cultivados con consorcios microbianos, utilizados en el tratamiento biológico de aire, condiciones necesarias para su desarrollo, así como para la captura de CO2 en un sistema acoplado de un FotoArLift (FAL) como postratamiento a un Biofiltro de Lecho Escurrido (BTF) que trata vapores de acetato de etilo (EA).
Objetivo
Operar un FAL acoplado como postratamiento a un BTF que trata vapores de EA para la refinación de emisiones gaseosas respecto a captura de CO2 y producción de oxígeno (pO2).
Planteamiento del problema
Si bien los sistemas de tratamiento biológico para COV en fase gas ya han sido ampliamente estudiados, las emisiones residuales de estas tecnologías contienen CO2 de origen biológico, proveniente de la degradación de estos compuestos. Estudios recientes para el tratamiento de EA reportan producciones de C-CO2 de hasta ∼700.4 g y 253.4 g en la operación total de biofiltros, por 231 y 171 días respectivamente3, 4.
Estos gases contribuyen a las emisiones totales de CO2, aumentando la temperatura global, los niveles del mar y derritiendo glaciares, todo esto provoca fenómenos meteorológicos extremos5, incluso se pronostica que para finales del actual siglo aumente entre 1.4 y 5.8 °C la temperatura media de la superficie del mar6. De acuerdo con Onyeaka et al. 7 esto se debe principalmente a la contribución de procesos antropogénicos como los industriales con el 21 %, actividades agropecuarias 24 %, electricidad y producción de calor 25 %, construcción 6 %, transporte 14 % y otras energías 10 %. Los GEI son responsables del cambio climático global y en el caso del CO2 representan hasta el 77 % de las emisiones totales8, aumentando a un ritmo del 2.2 % anual (Lim et al. 2), sin mencionar que para el año 2040 las emisiones de estos gases aumentarán alrededor de un 30 % (Dobslaw y Ortlinghaus, 2020)9.
Método de trabajo
Inóculo y medio mineral
Se utilizó un consorcio mixto de microalgas/bacterias, obtenido de una muestra de lodos, proveniente del río Turbio en León, Guanajuato, México; previo al arranque del sistema se aclimató el consorcio durante 14 días, con aire atmosférico comprimido y medio mineral Bold Basal (BBMM) selectivo para microalgas, compuesto por macro y micronutrientes, así como una fuente de nitrógeno de nitrato (N-NO3) adicionado como nitrato de sodio (NaNO3) con ajuste a pH=7.
Configuración experimental de FAL
Se describe la configuración del sistema en la Figura 2, que consta de un FAL operado en semicontinuo con una esponja de poliuretano, para favorecer la distribución del gas, acoplado como postratamiento al BTF, de vidrio con 0.07 m de diámetro interno, 0.5 m de altura, irradiado con lámparas de luz LED blanca 4.8 W dentro de una caja con 0.8 mL de volumen efectivo y con agitación neumática.
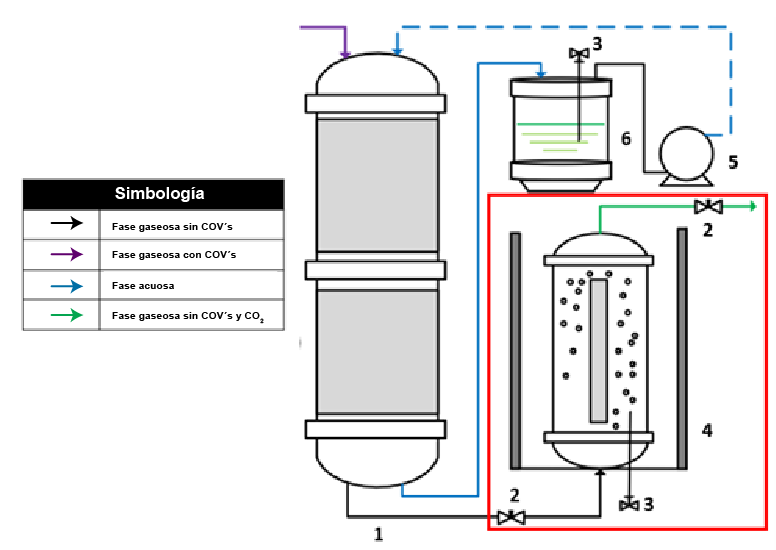
Figura 2. Esquema de FAL acoplado a un BTF. 1) BTF, 2) Válvula, 3) Puerto de muestreo de líquidos, 4) FAL, 5) Bomba peristáltica, 6) Reservorio de líquidos. Fuente: elaboración propia.
Operación del FAL acoplado a BTF
El arranque del sistema inició con la inoculación de los biorreactores con biomasa adaptada (BTF-FAL), posteriormente se establecieron flujos y concentraciones iniciales, así como presión y temperatura ambiente (20-25 °C y 1 atm). Se monitoreó la fase gaseosa, en términos de CO2 y pO2, pH y densidad óptica como contenido de biomasa (OD685 y OD440). El BTF como tratamiento principal, operó en estado estable para la degradación de vapores de EA con una eficiencia de remoción de ∼70 % y bajos porcentajes de mineralización. En este sentido, la alimentación al FAL contenía CO2 derivado de la conversión biológica de EA, así como muerte celular y concentraciones traza de EA no removido en el BTF; se mantuvo un flujo de aire a 0.85 L min-1 y un tiempo de residencia del gas (TR) de 57 s en FAL. Se presentan las condiciones operativas del sistema de cada etapa operacional en la Tabla 1, así como las ecuaciones para la evaluación del desempeño10.
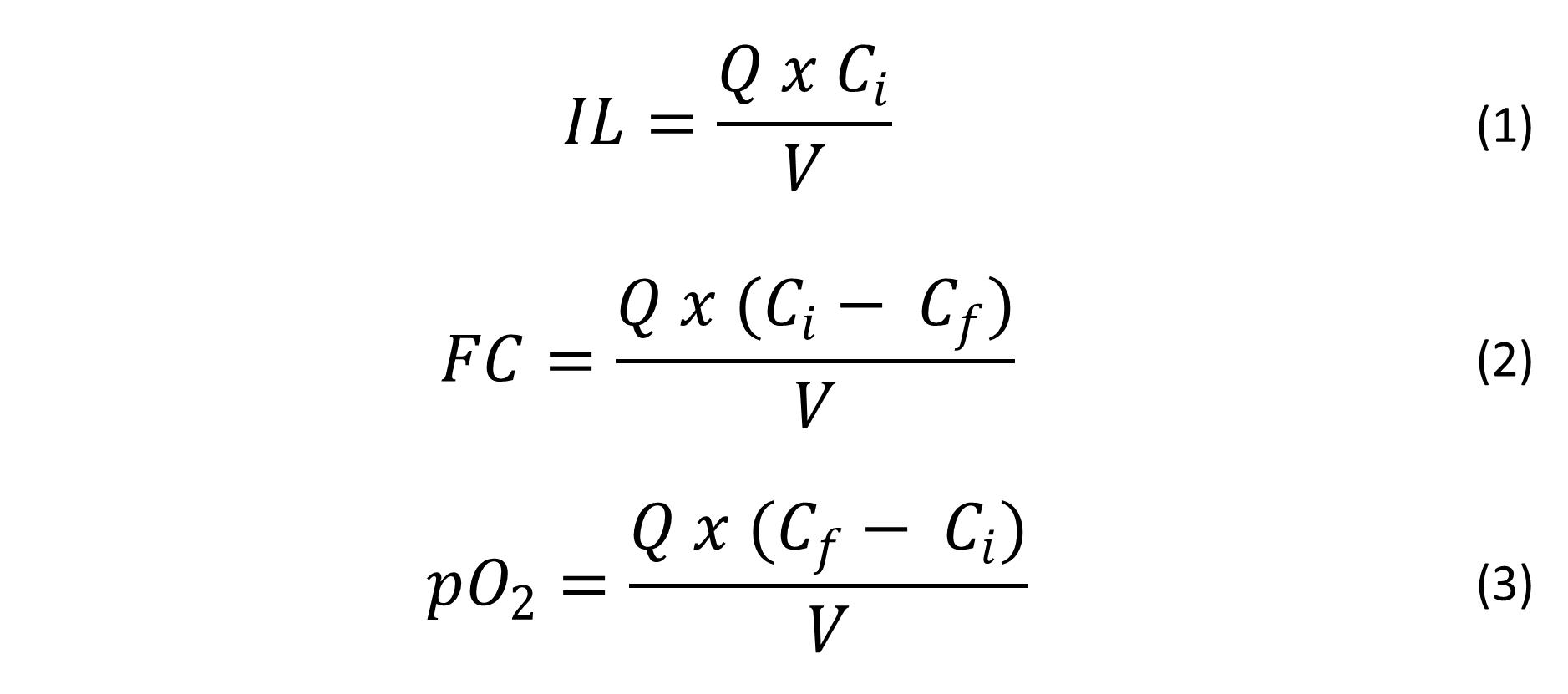
Donde IL es la carga inicial de CO2 producido en BTF (g m-3 h-1), Q es el flujo de aire (m3 h-1), Ci es la concentración inicial (g m-3), V es el volumen de reactor (m3), FC es la capacidad de captura de CO2 (g m-3 h-1), Cf es la concentración final (g m-3) y pO2 es la producción de O2 (g m-3 h-1).
Tabla 1. Condiciones operativas FAL
| Etapa | Tiempo (días) |
ILco2 (g m-3 h-1) |
pH | Intensidad de luz (μmol m-2 s-1) |
Q (L/min) |
TR (s) |
| I | 0-8 | 2.87 ± 1.11 | 6.49 ± 0.14 | 21.40±1.77 | 0.85 | 57 |
| II | 9-18 | 2.32 ± 0.78 | 6.70 ± 0.18 | 19.87±1.64 | 0.85 | 57 |
| III | 19-36 | 1.61 ± 0.60 | 6.57 ± 0.17 | 18.55±0.29 | 0.85 | 57 |
ILco2: carga inicial de CO2 producido en BTF; Q: flujo de aire; TR: tiempo de residencia del gas.
Monitoreo de gases
La concentración de CO2 se midió mediante un sensor (CO2METER), con método de detección Infrarrojo No Dispersivo (NDIR) y óptica chapada en oro, registrando unidades en partes por millón (ppm). La pO2 en fase gas se midió mediante un sensor UV utilizando el principio de extinción de la fluorescencia por el O2.
Caracterización de biomasa
Se determinó la fórmula de la biomasa en cada biorreactor y por etapas: se sugiere las siguientes ecuaciones de Rittman y McCarty11:
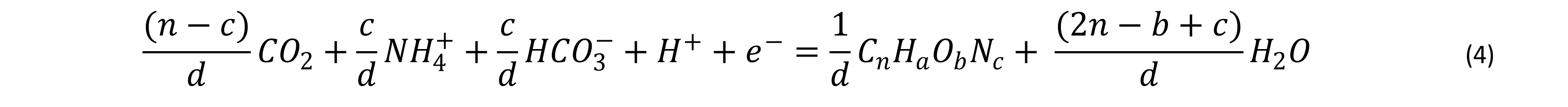
Donde:
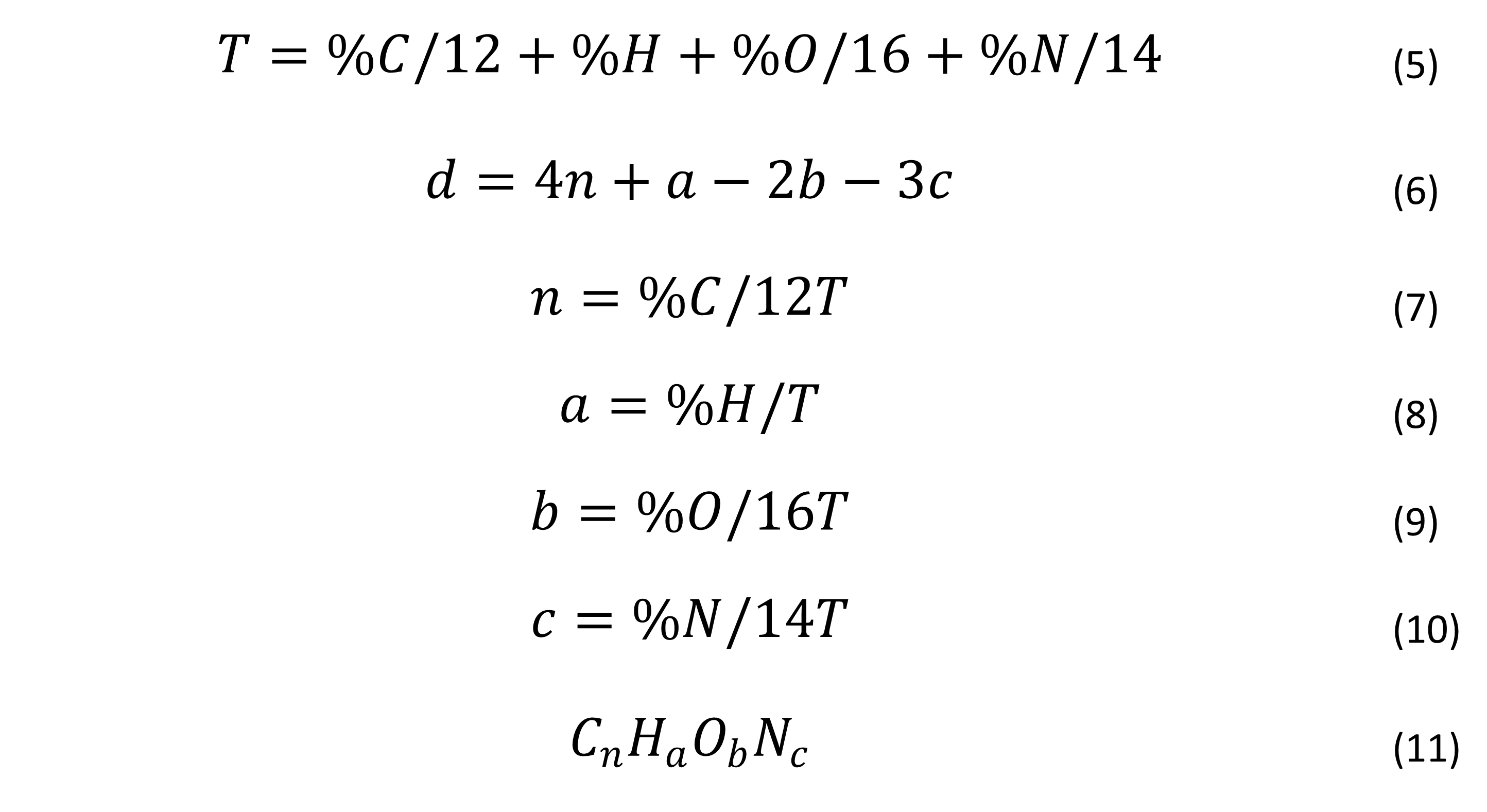
Se cuantificó el porcentaje contenido de CHNS en biomasa previamente obtenida de 400 mL del biorreactor, centrifugado a 5000 rpm durante quince minutos y secada a 105 °C durante 24 horas. Se pesaron 2 mg de muestra y 10 mg de catalizador V2O5 en cápsulas de estaño para analizar (analizador elemental FLASH 2000 marca Thermo scientific), con la finalidad de cerrar los porcentajes de contenido elemental, se cuantificó el porcentaje de cenizas a 550 °C en una mufla durante dos horas, mediante la siguiente ecuación:
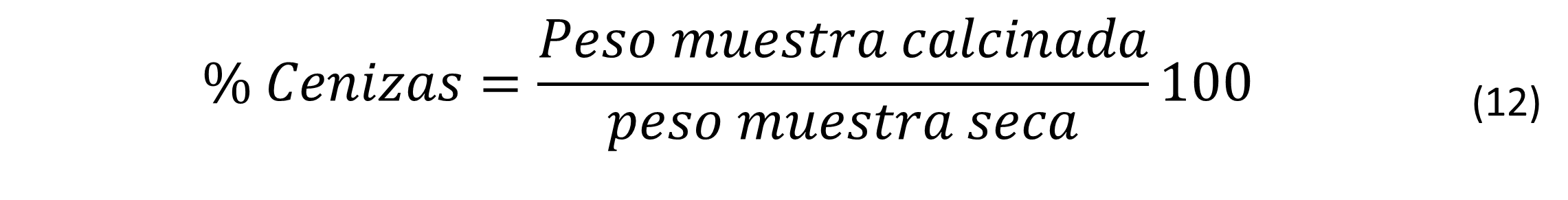
Se evaluó la tasa de crecimiento específico debido a la síntesis de biomasa, mediante la ecuación de Monod11, en la fase de crecimiento exponencial reportada por Fallahi et al.12 para un cultivo de mezcla microalgal utilizada en el tratamiento de aguas residuales municipales. Se monitoreó diariamente la concentración de biomasa en el FAL, a OD685 y OD440 respectivamente en espectrofotómetro visible (Genesys-30), se seleccionó esta longitud de onda debido a los picos caracteristicos observados en barridos de cada muestra. Se reportó la concentración como mg L-1 a partir de la curva de calibración entre absorbancia y peso de biomasa seca a 105 °C. Se presenta la curva de calibración en el material de soporte.

Donde μsyn es la tasa de crecimiento específica debido a la síntesis de biomasa (d-1), Xi y Xf es la concentración inicial y final respectivamente de biomasa activa (mg L-1) y t es el tiempo (días).
Resultados y análisis de datos
Desempeño del sistema
En las Figuras 3 y 4 se presenta, la carga orgánica de entrada de CO2 al FAL producido en el BTF (IL), la capacidad de captura de CO2 (FC), pO2 y el cambio del pH respecto al tiempo. El sistema acoplado operó durante 36 días, seccionados en tres etapas como se presenta en la Tabla 2 con las FC y pO2 promedio respectivas, modificando variables críticas del proceso como: reconfiguración del BTF para la etapa 2 y un aumento en la carga orgánica de EA en el BTF para la etapa 3, además, se inició la etapa dos con la adición de amonio (NH4) como fuente de nitrógeno extra al BBMM y la adición de fosfatos como amortiguadores de pH, debido a los cambios presentados por el reactor (Figura 4).
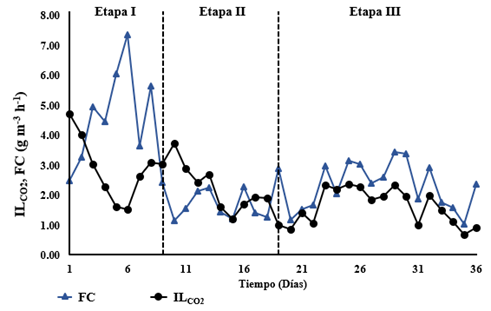
Figura 3. Carga inicial de CO2 producido en BTF (IL) y capacidad de captura de CO2 (FC) respecto al tiempo total de operación del FAL. Fuente: elaboración propia.
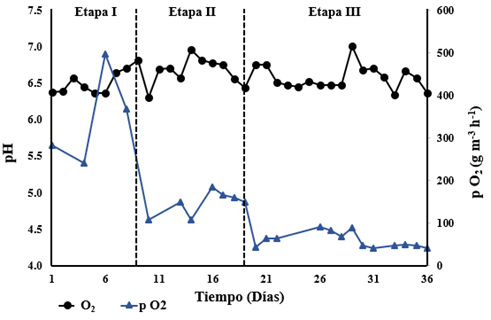
Figura 4. Cambio del pH respecto al tiempo y concentración de O2 producido pO2 respecto al tiempo. Fuente: elaboración propia.
Tabla 2. Desempeño del FAL en cada etapa operativa
| Etapa | Tiempo (Días) |
FC (g m-3 h-1) |
pO2 (g m-3 h-1) |
| I | 0-8 | 4.74 ± 1.61 | 347.08 ± 112.91 |
| II | 9-18 | 1.72 ± 0.50 | 145.42 ± 31.45 |
| III | 19-36 | 2.33 ± 0.76 | 65.15 ± 29.89 |
| FC: capacidad de captura de CO2; pO2: producción de O2. | |||
Balance estequiométrico
Se presentan las ecuaciones estequiométricas teóricas para la fórmula empírica de la biomasa mixta en cada etapa operacional, con CO2 como fuente de carbono y aceptor de electrones, NH4 como fuente de nitrógeno, así como agua (H2O) como donador de electrones.

Crecimiento de biomasa en fase exponencial del cultivo mixto
En la Figura 5 se presenta la velocidad de crecimiento específico como μ de síntesis, dada por la pendiente en la ecuación de la recta para el cultivo mixto a OD440 en FAL, graficando el logaritmo natural de la concentración de biomasa activa en mg L-1 (ln(X)) contra el tiempo de operación en la fase de crecimiento exponencial.
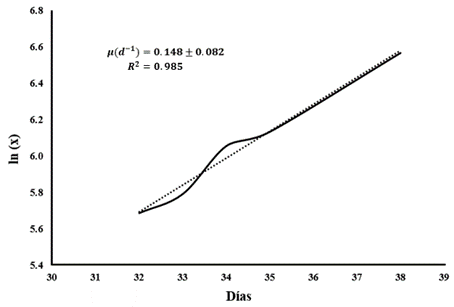
Figura 5. Velocidad específica de crecimiento en la fase exponencial de biomasa en FAL a OD440. Fuente: elaboración propia
Discusión
Desempeño del sistema
Durante las tres etapas operativas, el FAL presentó una alta eliminación del CO2 producido en el BTF, por la conversión de vapores de EA y aunque la FC es relativamente baja en comparación con Deprá et al.10, con hasta 41.66 g m-3 h-1, con cultivos puros como Scenedesmus obliquus CPCC05 e IL desde 1040 a 25x103 g m-3 h-1; comparado con los resultados de Mousavi et al.13 registra tasas de fijación de hasta 153, 302 y 278 g m-3 h-1 con un cultivo de Coleastrum sp. SM en FAL o Yaqoubnejad et al.14, que para un FAL registra tasas de fijación de hasta ∼41.7 g m-3 h-1. Sin embargo, también se registran cultivos puros, con tasas de fijación similares o incluso menores como 0.3, 0.43, 0.34, 3.1 g m-3 h-1 con cultivos de Chlorella sp., Dunaliella sp., Dunalliella salina DCCBC2, Euglena gracilis respectivamente15.
En la etapa I se registró una aparente diferencia en la FC, respecto a la II y la III, además se observó que la FC aumenta con la disminución en la IL, capturando incluso más que el CO2 total producido en el BTF; sin embargo, en las etapas II y III, la FC disminuye sin relación aparente con el IL, lo que se puede atribuir a la proliferación de microorganismos no fotosintéticos, por la mezcla de biomasa en el biorreactor y por lo tanto a las diferentes capacidades mixotróficas del cultivo, ya que además, en ausencia de luz, las microalgas utilizan compuestos orgánicos como fuente de energía con una necesidad mínima de luz, mineralizando los COV como EA en CO2, capturando en un mismo sistema CO2 como fuente de carbono inorgánico mientras biodegradan carbono orgánico en forma de COV. En este sentido, este tipo de postratamiento elimina incluso COV en fase gas16. Sin embargo, aunque la FC disminuye, continúa con un alto porcentaje respecto a la IL, con días de monitoreo donde también se capturaba una pequeña fracción del CO2 atmosférico.
Por otra parte, la pO2 registra tasas de producción muy altas respecto a la estequiometría teórica del sistema, en el orden ∼40 hasta ∼496 g m-3 h-1, más cercano a lo que reporta Deprá et al.10 con un cultivo puro de Scenedesmus obliquus CPCC05 y altas IL, lo que confirma la variedad del cultivo, ya que al tener estas altas tasas de producción, las tasas de captura tendrían que ser 10 o 100 veces más altas, sin embargo, en este sistema, al tiempo que se captura el CO2, la mineralización de COV por organismos no fotosintéticos e incluso microalgas con capacidades mixotróficas produce CO2 cuantificado a la salida del reactor.
Respecto al pH, el FAL presentó acidificación en los primeros días de operación, causado por la producción de metabolitos ácidos provenientes de la degradación incompleta del EA en el BTF17, estos metabolitos se deben principalmente a etanol y ácido acético4, 18, este último confirmado mediante detección de ácidos orgánicos volátiles por el método de destilación simple19.
Balance estequiométrico
Las ecuaciones estequiométricas, a través de las tres etapas operativas, presentan aparentemente alta similitud, sobre todo en la relación molar de O2 producido, sin embargo, la fórmula empírica de la biomasa cambia respecto al tiempo, lo que muestra el cambio en la composición de la biomasa, con posible aumento de microorganismos diferentes a microalgas, disminuyendo el desempeño del reactor, respecto a captura de CO2 y pO2. Estas ecuaciones dan apertura para un mejor diseño de reactores FAL como postratamiento a sistemas de tratamiento biológico de COV.
Velocidad específica de crecimiento de biomasa
Se registra una μ de síntesis (0.148 ± 0.082 d-1) similar a la reportada por Fallahi et al.12 para cultivos puros de Chlorella vulgaris y Scenedesmus obliquus con 0.15 d-1 y menor que para un cultivo de Nannochloropsis sp., así como una mezcla de microalgas utilizadas en el tratamiento de aguas residuales municipales; esta μ, cercana a cultivos puros, nos indica una adecuada tasa de crecimiento, considerando la mezcla de microalgas/bacterias del consorcio utilizado, ya que en este sentido, variaciones de la μ de síntesis se pueden atribuir a una gran variedad de parámetros, sin embargo, la intensidad de luz, así como la fuente de iluminación, es uno de los más críticos, Delgadillo-Mirquez et al.20 no reporta diferencia en la μ con diferentes periodos para un cultivo mixto microalgas/bacterias, sin embargo, cuando aumenta la temperatura de 15 a 25 °C, la tasa de crecimiento especifico aumenta ligeramente, en el caso del FAL, la diferente fuente de iluminación podría variar la temperatura del reactor, registrando diferentes tasas de crecimiento; además, Wang et al.21 reporta que una fuente de carbono orgánico, adicionado a luz LED y nutrientes como el sistema acoplado del presente trabajo, con vapores remanentes de EA, puede ser beneficioso para una mayor eficiencia de crecimiento y rendimiento de biomasa en cultivos mixtos de microalgas.
Conclusiones
En resumen, los cultivos mixtos presentan una solución prometedora y versátil en el tratamiento biológico del aire, a través de sus capacidades metabólicas mixotróficas. Estos cultivos pueden abordar tanto los COV como el CO2, aunque sus eficiencias individuales pueden no ser tan altas como las de los cultivos puros, sus ventajas económicas y multifuncionales son notables: estos cultivos microbianos se adaptan eficazmente a diversas fuentes de carbono y energía, lo que permite la captura y degradación simultánea de COV y CO2 en un mismo sistema de tratamiento biológico de aire; además de su capacidad de reducción de emisiones de carbono a la atmósfera, los sistemas de cultivos de microalgas/bacterias tienen un alcance más amplio, desde la refinación de biogás y la remoción de malos olores en Plantas de Tratamiento de Aguas Residuales (PTAR) hasta la producción de compuestos valiosos, utilizados en diversas industrias, estos sistemas ofrecen una solución sostenible y eficiente.
Este trabajo ejemplifica la versatilidad de estos cultivos con el acoplamiento de un FAL como postratamiento a un BTF. Al capturar CO2 durante el tratamiento de EA, se demuestran eficiencias notables en la reducción de emisiones de GEI y COV, además, aunque las eficiencias pueden variar, según la configuración y el sistema, los resultados de investigación respaldan la capacidad de los cultivos mixtos para abordar desafíos ambientales y generar beneficios económicos.
En última instancia, los cultivos de microalgas ofrecen un enfoque innovador para enfrentar los problemas atmosféricos, su capacidad de adaptación, junto con su habilidad para capturar CO2 y biodegradar COV, los convierte en herramientas valiosas en la batalla contra la contaminación atmosférica. Más allá de su contribución a la mitigación de la contaminación, también presentan una oportunidad para la producción sostenible de valiosos productos químicos y biomoléculas, utilizadas en diversas industrias. Con una aplicación escalable y una amplia gama de beneficios, los cultivos de microalgas abren un camino hacia un futuro más limpio y sostenible en la gestión de la calidad del aire.
Referencias
1. AL-DAILAMI, A., Koji, I., Ahmad, I. y Goto, M. Potential of Photobioreactors (PBRs) in Cultivation of Microalgae. Journal of Advanced Research in Applied Sciences and Engineering Technology. [En línea]. Vol. 27 (1). 2022. DOI 10.37934/araset.27.1.3244. ISSN 2462-1943.
2. LIM, Y. A., Chong, M. N., Foo, S.C. e Ilamkoom, I.M.S.K. Analysis of direct and indirect quantification methods of CO2 fixation via microalgae cultivation in photobioreactors: A critical review. Renewable and Sustainable. Energy Reviews. [En línea]. Vol. 137. 2021. DOI 10.1016/j.rser.2020.110579. ISSN 1879-0690.
3. FLORES-BARBOSA, A. B., Aizpuru, A., Quijano, G. y Arriaga, S. Evaluation of bioaerosols by flow cytometry and removal performance in a biofilter treating toluene/ethyl acetate vapors. Chemosphere. [En línea]. Vol. 251. 2020. DOI 10.1016/j.chemosphere.2020.126404. ISSN 1879-1298.
4. COVARRUBIAS-GARCÍA, I., Aizpuru, A. y Arriaga, S. Effect of the continuous addition of ozone on biomass clogging control in a biofilter treating ethyl acetate vapors. Science of the Total Environment. [En línea]. pp. 584-585. 2017. DOI 10.1016/j.scitotenv.2017.01.031. ISSN 1879-1026.
5. ZHANG, S. y Liu, Z. Advances in the biological fixation of carbon dioxide by microalgae. Journal of Chemical Technology and Biotechnology. [En línea], Vol. 96 (6). 2021. DOI 10.1002/jctb.6714. ISSN 1097-4660.
6. GATAMANENI, B. L., Orsat, V. y Lefsrud, M. Factors Affecting Growth of Various Microalgal Species. Environmental Engineering Science. [En línea]. Vol. 35 (10). 2018. DOI 10.1089/ees.2017.0521. ISSN 1557-9018.
7. ONYEAKA, H., Miri, T., Obileke, K.C., Hart, A., Anumudu, C. y Al-Sharify, Z. T. Minimizing carbon footprint via microalgae as a biological capture. Carbon Capture Science and Technology. [En línea]. Vol. 1. 2021. DOI 10.1016/j.ccst.2021.100007. ISSN 2772-6568.
8. ANWAR, M. N., Fayyaz, A., Sohail, N. F., Khokhar, M. F., Baqar, M., Yasar, A., Rasool, K., Nazir, A., Raja, M. U. F., Rehan, M., Aghbashlo, M., TabatabaeI, M. y Nizami, A. S. CO2 utilization: Turning greenhouse gas into fuels and valuable products. Journal of Environmental Management. [En línea]. Vol. 260. 2020. DOI 10.1016/j.jenvman.2019.110059. ISSN 1095-8630.
9. DOBSLAW, D. y Ortlinghaus, O. Biological waste air and waste gas treatment: Overview, challenges, operational efficiency, and current trends. Sustainability (Switzerland). [En línea]. Vol. 12 (20). 2020. DOI 10.3390/su12208577. ISSN 2071-1050.
10. DEPRÁ, M. C., Dias, R. R., Severo, I. A., De Menezes, C. R., Zepka, L. Q. y Jacob-Lopes, E. Carbon dioxide capture and use in photobioreactors: The role of the carbon dioxide loads in the carbon footprint. Bioresource Technology. [En línea]. Vol. 314. Octubre de 2020. DOI 10.1016/j.biortech.2020.123745. ISSN 1873-2976.
11. RITTMAN, Bruce E.; McCarty, Perry L. Environmental biotechnology: principles and applications. McGraw-Hill Series in Water Resources and Environmenta Engineering. 2001. ISBN: 9781260440591.
12. FALLAHI, A., Hajinajaf, N., Tavakoli, O. y Sarrafzadeh, M. H. Cultivation of mixed microalgae using municipal wastewater: Biomass productivity, nutrient removal, and biochemical content. Iranian Journal of Biotechnology. [En línea]. Vol. 18 (4). Diciembre 2020. DOI 10.30498/IJB.2020.2586. ISSN 2322-2921.
13. MOUSAVI, S., Najafpour, G. D. y MohammadI, M. CO2 bio-fixation and biofuel production in an airlift photobioreactor by an isolated strain of microalgae Coelastrum sp. SM under high CO2 concentrations. Environmental Science and Pollution Research. [En línea]. Vol. 25, pp. 30139 - 30150. 2018. DOI 10.1007/s11356-018-3037-4. ISSN 1614-7499.
14. YAQOUBNEJAD, P., Rad, H. A. y Taghavijeloudar, M. Development a novel hexagonal airlift flat plate photobioreactor for the improvement of microalgae growth that simultaneously enhance CO2 bio-fixation and wastewater treatment. Journal of Environmental Management. [En línea]. Vol. 298. 2021. DOI 10.1016/j.jenvman.2021.113482. ISSN 1095-8630.
15. MORALES, M., Sánchez, L. y Revah, S. The impact of environmental factors on carbon dioxide fixation by microalgae. FEMS Microbiology Letters. [En línea]. Vol. 365 (3). 2018. DOI 10.1093/femsle/fnx262. ISSN 1574-6968.
16. RAJENDRAN, L., Nagarajan, N. G. y Karuppan, M. Enhanced biomass and lutein production by mixotrophic cultivation of Scenedesmus sp. using crude glycerol in an airlift photobioreactor. Biochemical Engineering Journal. [En línea]. Vol. 161. 2020. DOI 10.1016/j.bej.2020.107684. ISSN 1873-295X.
17. OLIVA, G., Ángeles, R., Rodríguez, E., Turiel, S., Naddeo, V., Zarra, T., Belgiorno, V., Muñoz, R. y Lebrero, R. Comparative evaluation of a biotrickling filter and a tubular photobioreactor for the continuous abatement of toluene. Journal of Hazardous Materials. [En línea]. 2019. DOI 10.1016/j.jhazmat.2019.120860. ISSN 1873-3336.
18. DESHUSSES, M., Johnson, C. T. y Leson, G. Biofiltration of high loads of ethyl acetate in the presence of toluene. Journal of the Air and Waste Management Association. [En línea]. Vol. 49 (8). 1999. DOI 10.1080/10473289.1999.10463869. ISSN 1047-3289.
19. AMERICA PUBLIC HEALTH ASSOCIATION. Method 5560-C “Distillation Method”, Standard Methods for the Examination of Water and Wastewater. Washington, DC. 1989. 17th Edition, pp. 5-83 a pp. 5-84.
20. DELGADILLO-MIRQUEZ, L., Lopes, F., TaidI, B. y Pareau, D., Nitrogen and phosphate removal from wastewater with a mixed microalgae and bacteria culture. Biotechnology Reports. [En línea]. Vol. 11, pp. 18-26. 2016. DOI 10.1016/j.btre.2016.04.003. ISSN 2215-017X.
21. WANG, X., Ding, S., Wang, M., Ma, X., Li, H., Zhang, Y., Song, W., Ding, J. y Lu, J. Effects of light source and inter-species mixed culture on the growth of microalgae and bacteria for nutrient recycling and microalgae harvesting using black odorous water as the medium. Environmental Science and Pollution Research. [En línea]. Vol. 29 (52). 2022. DOI 10.1007/s11356-022-21293-9. ISSN 1614-7499.



