Año 3, Número 1. Septiembre - Diciembre, 2015 
Guanábana (Annona muricata L.) en polvo secado por aspersión
Soursop (Annona muricata L.) in powder spray drying
Sociedad Mexicana de Biotecnología y Bioingeniería (SMBB)
Por: Salvador González Palomares, Alejandro Hernández Estrada y Héctor Manuel González Sánchez / Ver en pantalla completa
Resumen
En el presente trabajo se estudió la obtención de guanábana en polvo secado por aspersión. El objetivo fue evaluar la encapsulación con maltrodextrina DE-10, goma arábiga y secado por aspersión con base en la conservación de compuestos volátiles en el producto en polvo de guanábana. Se estudiaron tres tratamientos de encapsulantes (maltodextrina DE-10, goma arábiga y una mezcla de ambos), con base en la retención de compuestos volátiles durante el secado. Los compuestos volátiles se identificaron mediante microextracción en fase sólida (SPME) y cromatografía de gases-espectrometría de masas (GC-MS). Se encontró que el mejor tratamiento de secado por aspersión de guanábana fue la mezcla de maltodextrina DE-10 y goma arábiga (1:1) p/p. Se obtuvo un producto de guanábana en polvo secado por aspersión, fácil de diluir en agua purificada, fácil de conservar y con facilidad de utilizarse en los alimentos.
Palabras clave: Compuestos volátiles, guanábana en polvo, secado por aspersión.
Astract
In this article, the production of soursop in spray dried powder was studied. The aim was to evaluate the encapsulation with DE-10 maltodextrin, gum arabic and spray drying based on the conservation of volatile compounds in the powder soursop. Encapsulation three treatments (DE-10 maltodextrin, gum arabic and a mixture of both) were studied based on the retention of volatile compounds during drying. Volatile compounds were identified by solid phase microextraction (SPME) and gas chromatography-mass spectrometry (GC-MS). It was found that the best treatment of soursop spray drying was the mixture of DE-10 maltodextrin and gum arabic (1:1) p/p. Soursop product was obtained in spray dried powder, easy to dilute in purified water, easy to maintain and easily used in food.
Keywords: Volatile compounds, soursop powder, spray drying.
Introducción
La guanábana es fuente de nutrientes, fitoquímicos y antioxidantes importantes para la salud humana. Esta fruta es originaria del Caribe, México, Centro y Sudamérica. Se introdujo a muchos países tropicales y subtropicales, incluido China, Australia y Polinesia1,2,3. Los estados de la República Mexicana productores de guanábana son Nayarit, Colima, Veracruz, Tabasco, Oaxaca, Campeche, Guerrero y Chiapas. El principal productor es el estado de Nayarit con una superficie de 2,300 ha4. Entre las bondades de la guanábana se destaca que tiene pulpa dulce, blanca, cremosa, jugosa, suave y ligeramente ácida, con excelentes características sensoriales3,5,6. El producto deshidratado puede tener diversas aplicaciones en helados, aguas frescas, dulces, industria de saborizantes de alimentos, productos lácteos y repostería. La intención fue retener compuestos volátiles relacionados con el aroma y sabor de la guanábana. Los compuestos volátiles de la guanábana se han estudiado por diversos investigadores6,7,8,9,10. Ellos informan que los compuestos volátiles de la guanábana pueden variar con base en la variedad de los frutales, manejo agronómico, lugar de producción, método de extracción y condiciones cromatográficas.
Por otro lado, es importante mencionar que el secado por aspersión es un proceso unitario útil para deshidratar soluciones acuosas, emulsiones y purés de baja viscosidad, y así obtener productos en polvo. El secado por aspersión es muy usado en la industria química y de alimentos para la obtención de saborizantes en polvo y productos, tales como café, leche, naranja, mango, jamaica y sandía, entre otros. El secado por aspersión es un proceso flexible, adaptable a numerosas aplicaciones y relativamente económico. El secado por aspersión consiste en asperjar una solución acuosa en diminutas gotas a través de un atomizador en la cámara de un secador, las cuales al entrar en contacto con el aire caliente generado por una resistencia, se deshidratan y se obtiene un producto en polvo. Las condiciones más adecuadas en la operación de un secador por aspersión son donde se conserve la mayor cantidad de compuestos y las principales características de interés del producto, ya sea propiedades sensoriales o medicinales11.
Durante el secado por aspersión, los alimentos pueden modificar sus compuestos y con ello algunas de sus principales propiedades sensoriales o medicinales. Para evitar lo anterior, actualmente se aplica el procedimiento de la encapsulación, que consiste en emplear materiales que funcionan como recubrimientos, mejor conocidos como materiales encapsulantes11,12,13. En esta investigación los encapsulantes utilizados fueron maltrodextrina DE-10 y goma arábiga.
Debido a la importancia de conservar productos básicos de frutas como la guanábana, el objetivo del presente trabajo fue evaluar la encapsulación con maltrodextrina DE-10, goma arábiga y secado por aspersión con base en la conservación de compuestos volátiles en el producto en polvo de guanábana.
Método de trabajo
Obtención del extracto de guanábana
Las guanábanas que se utilizaron en este proyecto fueron frutas maduras, sanas, frutas criollas, recién cosechadas, procedentes de un mercado local de Colima, Colima, México. El extracto de guanábana se realizó de forma manual: se quitó la cáscara a las guanábanas con un cuchillo, enseguida se retiraron las semillas, se licuó la pulpa y enseguida se filtró. Se realizaron diversas filtraciones, esto fue importante para obtener un extracto con pureza. Es decir, libre de la mayor cantidad posible de fibra para no tapar las boquillas del atomizador rotatorio del secador por aspersión. El extracto obtenido tuvo un 10 % de sólidos solubles, esto se midió en un refractómetro Atago. Se obtuvieron 60 L de extracto de guanábana, y se conservó en refrigeración a 4 ºC durante 2 h.
Encapsulación y secado por aspersión de guanábana
El concentrado de guanábana se separó a la vez en ocho muestras, cada una de 7 L. Se evaluaron tres tratamientos de encapsulantes y un testigo, como se menciona en la Tabla 1. Los encapsulantes se agregaron a estas muestras homogeneizando en un molino coloidal Marca Colmil, Mod. AD-150, para la completa disolución. Los encapsulantes se compraron en Aranceles Arancia de Guadalajara, Jalisco, México11.
Tabla 1. Tratamientos de encapsulantes y variables evaluadas en las muestras de guanábana.
| Tratamientos: | Variables evaluadas: | |||
|---|---|---|---|---|
|
|
|
|
|
|
T0: Testigo (sin encapsulantes). |
Se midió el contenido de humedad en todas las muestras en polvo secado por aspersión (%). |
Se pesaron todas las muestras secadas por aspersión en una balanza analítica |
Se midió el pH en las muestras de guanábana (antes y después del secado). En el caso de las muestras después del secado, se reconstituyeron porciones del polvo en agua destilada en la misma concentración que había antes del secado. |
Se caracterizaron los compuestos volátiles en las muestras de guanábana (antes y después del secado). |
T1: 0.6 % p/p de maltodextrina DE-10. |
||||
T2: 0.6 % p/p de goma arábiga. |
||||
T3: 0.6 % de una mezcla de maltodextrina DE-10 y goma arábiga (1:1) p/p. |
||||
Nota. Los tratamientos se evaluaron con 3 repeticiones con base en la retención de compuestos volátiles de la guanábana durante el secado por aspersión. P/p significa una relación de peso – peso en gramos. Es decir, se aplicaron las cantidades de encapsulantes en relación al peso de cada muestra de guanábana.
El secado de las muestras se realizó en un secador por aspersión (modelo B290, Büchi, Flawil, Suiza) a una velocidad de secado de 1 kg/h de agua. La mezcla fue alimentada a la cámara de secado a temperatura ambiente a través de una bomba peristáltica con un flujo ajustado a 0.49 Kg/h. El secado por aspersión se realizó con un atomizador rotatorio con diámetro 0.7 mm, un aire de secado con un flujo de 0.36 m3/h (Figura 1). La temperatura de entrada del secado fue de 180 ºC y la temperatura de salida de 75 ºC. Las muestras de guanábana en polvo secado por aspersión se colocaron en frascos herméticos y se almacenaron en desecadores con sílice hasta su utilización11.
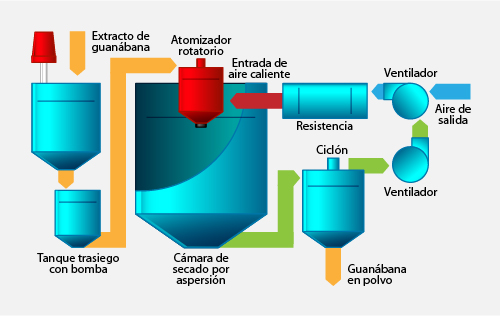
Ampliar imagen
Figura 1. Diagrama del secado por aspersión de guanábana.
Análisis de humedad, peso y pH
Se determinó el contenido de humedad en todas las muestras de guanábana en polvo secado por aspersión. Las muestras se pesaron en una balanza analítica, y se secaron en un horno de vacío a 70 °C12. Se midió el pH en un pH-metro encontrando que el concentrado de guanábana original (antes del secado), tuvo un pH de 4.0.
Análisis de compuestos volátiles
Se caracterizaron los compuestos volátiles en las muestras de guanábana, antes y después del secado por aspersión. Se usó el método de microextracción en fase sólida (SPME), usando una fibra de carbowax/divinilbenceno (CW/DVB, 65 µm). La fibra procede de Supelco, Bellefonte, PA, USA. Se usaron 8 g del concentrado de guanábana, 1 g de NaCl y 8 mL de agua desioinizada (Barnsted E-pure) en un vial de 40 mL, y se incubó a 70 ºC en un termobaño con agitación durante 30 min. Después de este tiempo, la fibra de SPME se insertó en el espacio de cabeza del vial, manteniéndose la temperatura y la agitación durante 30 min. Al finalizar el tiempo de extracción, se retiró del vial la fibra con los compuestos volátiles adsorbidos y se insertó en el puerto de inyección de un cromatógrafo de gases con un tiempo de desorción de 5 min (tres repeticiones).
Los compuestos volátiles de la guanábana se analizaron en un cromatógrafo de gases Shimadzu® GC-17A acoplado a un detector selectivo de masas QP5050. Se usó una columna RTX-5 sílice fundida (Restek®, 30 m x 0.32 mm id, con un espesor de película de 0.25 mm). Las condiciones en la identificación de compuestos volátiles de guanábana fueron: temperatura del inyector y del detector de 190 °C y 240 ºC, respectivamente. Se estableció una temperatura inicial del horno de 40 ºC, mantenida por 5 min hasta llegar a una temperatura final de 250 ºC con incrementos de 5 ºC/min. El gas acarreador fue helio grado cromatográfico (INFRA S.A.), con un flujo de 0.8 mL/min. Los compuestos volátiles se identificaron por comparación espectral de los picos del cromatograma de iones totales de las muestras con los compuestos de referencia de la biblioteca CLASS-5000 instalada en el GC-MS. La cuantificación se realizó con base en el porcentaje de área de cada pico del cromatograma correspondiente a cada compuesto volátil de la guanábana10,13.
Análisis estadístico
Los resultados de la cuantificación de compuestos volátiles de la guanábana fueron evaluados estadísticamente mediante el análisis de varianza (ANOVA) y el programa de estadística 8.0 (StatSoft, Inc., Tulsa, OK).
Resultados y discusión
En el extracto de guanábana se identificaron 17 compuestos volátiles (antes del secado por aspersión), mismos que se presentan en la Tabla 2 en la columna Tx. Un aspecto importante de este proyecto es explicar cómo se dio la conservación de compuestos volátiles durante el proceso de secado por aspersión de las muestras. En este sentido se observa en la Tabla 2, que en el tratamiento T0 (sin encapsulantes), disminuyeron bastante los compuestos volátiles. De los tratamientos evaluados se puede decir que fue mejor el T3, el cual es muy similar al contenido original, Tx en la retención de compuestos volátiles durante el secado por aspersión de guanábana.
Tabla 2. Compuestos identificados en las muestras de guanábana.
| Compuestos: | Concentración relativa de los compuestos de las muestras de guanábana (% de área): | ||||
|---|---|---|---|---|---|
| Metil hexanoato | 18.01ª | 0.12c | 6.80b | 7.01b | 16.90a |
| Metil 2-hexenoato | 15.30ª | 4.00bc | 5.00b | 5.04b | 15.10ª |
| Etil acetato | 4.00ª | 1.00b | 1.04b | 1.10b | 3.00ª |
| Metil butanoato | 1.13ª | -- | 0.11b | 0.90ª | 1.00ª |
| (E)-2-Hexenal | 2.42ª | 2.22ª | 2.30ª | 3.31ª | 2.32ª |
| 3-Hexenol | 1.44ª | 0.22b | 0.90ª | 0.99ª | 1.09ª |
| (E, E) -2,4-hexadienal | 3.46ª | 0.30b | 3.00ª | 3.04ª | 3.03ª |
| Etil hexanoato | 1.60ª | -- | 0.11b | 0.89ab | 1.30ª |
| Hexenil acetato | 2.40ª | 0.60b | 1.30ab | 1.50ab | 2.35ª |
| Acetato de 3-hexenol | 2.50ª | 0.29b | 2.00ª | 2.01ª | 2.03ª |
| 2-Etil hexanoato | 3.64ª | 0.40c | 1.30b | 1.39b | 3.14ª |
| Linalol | 2.45ª | 0.50c | 1.50b | 1.53b | 2.03ª |
| Metil octanoato | 3.14ª | 0.30c | 1.01b | 1.40b | 3.08ª |
| α-terpinoleno | 4.22ª | 0.55c | 1.50b | 1.46b | 4.00ª |
| Nonanal | 9.52ª | 1.30c | 4.00bc | 5.09b | 9.43ª |
| Metil 2-octanoato | 2.44ª | -- | 0.11b | 0.30b | 2.01ª |
| Oxanona | 8.33ª | 2.95c | 5.40b | 4.90b | 8.05ª |
| Total: | 17 | 14 | 17 | 17 | 17 |
| Nota. Los datos de cada compuesto que comparten las mismas letras en diferentes tratamientos (observado en renglón), indican que no tuvieron diferencia significativa (DMS por Duncan P < 0.05). Tx: extracto original (sin secar por aspersión), T0: sin encapsulantes, T1: 0.6 % p/p de maltodextrina DE-10, T2: 0.6 % p/p de goma arábiga y T3: 0.6 % de una mezcla de maltodextrina DE-10 y goma arábiga (1:1) p/p | |||||
El metil hexanoato y metil 2-hexenoato fueron los más abundantes, lo cual coincide con MacLeod y Pieris7, quienes caracterizaron los compuestos volátiles de guanábana por extracción – destilación simultánea (SDE) con solvente orgánico. Los compuestos de guanábana coincidieron en la identificación que realizaron Márquez y colaboradores6, en Guanábana de Colombia mediante SPME / GC-MS; las diferencias entre este trabajo y de dichos autores fueron cuantitativas en el contenido de los compuestos.
En la Tabla 3 se presentan los resultados de contenido de humedad, peso y pH en las muestras de guanábana secadas por aspersión. Se obtuvo que las muestras del tratamiento T3, fueron mejores, con un contenido de humedad adecuado en el producto en polvo, el mejor peso (g), así como la estabilidad del pH11.
Tabla 3. Datos evaluados en las muestras de guanábana secadas por aspersión.
| Variable evaluada: | ||||
|---|---|---|---|---|
| Humedad (%): | 3.9 | 3.0 | 3.0 | 3.0 |
| Peso (g): | 80 | 114 | 120 | 120 |
| pH: | 4.5 | 4.0 | 4.0 | 4.0 |
El producto de guanábana en polvo obtenido mediante secado por aspersión en este proyecto, puede ser útil para utilizarse en la elaboración de aguas frescas, dulces, mermeladas y en diversos alimentos, como saborizante natural de esta fruta.
Conclusiones
El compuesto más abundante en la guanábana de Colima fue el metil hexanoato. La mezcla de maltodextrina DE-10 y goma arábiga fue el mejor tratamiento para la retención de compuestos volátiles durante el secado por aspersión de guanábana, ya que formó una película viscoelástica y fue selectivamente permeable para permitir la evaporación del agua durante el proceso, pero con capacidad de conservar los compuestos, sin haber diferencia significativa con los compuestos encontrados antes del secado por aspersión (extracto original).
Recomendaciones
Algunos de los problemas que se encontraron en este trabajo, primero fue filtrar lo mejor posible el concentrado de guanábana, de tal manera que no tuviera residuos de fibra. Considerando que el contenido de fibra puede bloquear el flujo de alimentación en el atomizador rotatorio del secador por aspersión. En las muestras sin agentes encapsulantes se tuvieron problemas en el secado por aspersión, estos problemas fueron pegajosidad en las paredes del secador debido al contenido de azucares de la fruta. Esto genera pérdidas del producto y mucho tiempo para la limpieza de la cámara del secador. Este problema se resolvió adecuadamente con el uso de los agentes encapsulantes.
Agradecimientos
Al Consejo Estatal de Ciencia y Tecnología de Jalisco (COECYTJAL) por el apoyo recibido para el desarrollo del presente proyecto de investigación.
Referencias
1. LAKO, J., TRENERRY, V.C., WAHLQVIST, M., WATTANAPENPAIBOON, N., SOTHEESWARAN, S., and PREMIER, R. “Phytochemical flavonols, carotenoids and the antioxidant properties of a wide selection of Fijian fruit, vegetables and other readily available foods”. Food Chemistry, 2007. p. 101(4):1727–1741.
2. CHIMENOS, K.E. “Aspectos prácticos en la prevención del cáncer oral”. En: Avances de Odontoestomatollogy, 2008. p. 24(1):61-67.
3. MÁRQUEZ, C.C.J. “Caracterización fisiológica, físico-química, reológica, nutraceútica, estructural y sensorial de la guanábana (Annona muricata L. cv. Elita)”. Tesis de doctor en ciencias. Universidad Nacional de Colombia, Sede Medellín, Colombia, 2009. p. 274.
4. VIDAL, H.L., LÓPEZ, M.H., VIDAL, M.N.A., RUIZ, R.B., CASTILLO, R.D.G., y CHIQUITO, C.R.G. “La situación de las annonaceae en México: principales plagas, enfermedades y su control”. Revista Brasileira de Fruticultura, 2014. p. 36(1):44-54.
5. CUADROS, V. “Guanábana: Manejo del cultivo y poscosecha”. 1era ed. Proexant. Quito, Ecuador, 2008. p. 25.
6. MÁRQUEZ, C.C.J., CARTAGENA, V.J.R., and CORREA, L.G.A. “Determination of Soursop (Annona muricata L. cv. Elita) fruit volatiles during ripening by electronic nose and gas chromatography coupled to mass spectroscopy”. Revista Facultad Nacional de Agronomía, Medellín, 2013. p. 66(2):7117-7128.
7. MACLEOD, J.A., and PIERIS, M.N. “Volatile flavor components of soursop (Annona muricata)”. Journal of Agricultural Food Chemistry, 1981. p. 29(3):488-490.
8. CHEONG, K.W., TAN, C.P., MIRHOSSEINI, H., HAMID, N.S.A., OSMAN, A., and BASRI, M. “Equilibrium headspace analysis of volatile flavor compounds extracted from soursop (Annona muricata) using solid-phase Microextraction”. Food Research International, 2010. p. 43(5):1267-1276.
9. CHEONG, K.W., TAN, C.P., MIRHOSSEINI, H., CHIN, C.T., CHE-MAN, Y.B., HAMID, N.S.A., OSMAN, A., and BASRI, M. “Optimization of equilibrium headspace analysis of volatile flavor compounds of Malaysian soursop (Annona muricata): comprehensive two-dimensional gas chromatography time-of-flight mass spectrometry (CGxGC-TOFMS)”. Food Chemistry, 2011. p. 125(4):1481-1489.
10. GONZÁLEZ-PALOMARES, S., MÓNICO-JIMÉNEZ, J.C., DEL VAL-DÍAZ, R., MACEDO-GONZÁLEZ, L.A., RAMOS-RUBIO, A., y GARCÍA-ESTRADA, J. "Identificación de compuestos volátiles de guanábana (Annona muricata L.) de Colima, Colima." Revista PROYECTA TEC. Instituto Tecnológico Superior de Teposcolula, 2015. p. 2:7-10.
11. GONZÁLEZ-SÁNCHEZ, H.M., GONZÁLEZ-PALOMARES, S., y ROSALES-REYES, T. “Caracterización de compuestos volátiles durante el secado por aspersión de jugo de sandía (Citrullus lanatus Thunb.)”. Revista Investigación y Ciencia de la Universidad Autónoma de Aguascalientes, 2011. p. 51:10-15.
12. AOAC, Association of Official Analytical Chemists. “Official Methods of Analysis of the Association of Official Analytical Chemists”. 18th ed.; Gaithersburg, MD: AOAC Press. 2006.
13. GONZÁLEZ-PALOMARES, S., ESTARRÓN-ESPINOSA, M., GÓMEZ-LEYVA, J.F., FLORES-MARTÍNEZ, H., y ANDRADE-GONZÁLEZ, I. “Caracterización de compuestos volátiles en un extracto de jamaica (Hibiscus sabdariffa L.) por diferentes métodos de aislamiento y GC-MS” [en línea]. Memoria del IV Congreso Internacional y XV Congreso Nacional de Ingeniería Bioquímica. CMIB, A.C. Morelia, Michoacán, México. [ref. de 7 de abril del 2006]. Disponible en Web:
http://www.researchgate.net/publication/266740776 CARACTERIZACIN DE COMPUESTOS VOLTILES EN UN EXTRACTO DE JAMAICA %28Hibiscus sabdariffa L.%29 POR DIFERENTES MTODOS DE AISLAMIENTO Y GC-MS.



